卵巢癌通常被称为“沉默杀手”,因为直到癌症扩散它的症状才会表现。2013年,美国国家癌症研究所预测这一年会有22240位女性被诊断有卵巢癌,14030名女性会死于这种病。
2月24日,临床肿瘤学杂志上一项最新的研究发现,女性携带一种BRCA1突变基因,在35岁前切除她们的卵巢可明显的降低她们的患卵巢癌死亡的可能性。“我们有强大的基础来推荐带有BRCA1突变基因的女性最好进行卵巢切除手术,且最好在35岁之前做。” 加拿大多伦多大学医学教授,首席研究员Steven Narod说。

切除卵巢可有效降低患癌风险
在这项研究中,来自北美和欧洲的科学家用国际注册表来识别携带BRCA突变基因的5783名女性。在这些女性中,2270人没有切除她们的卵巢,另外2123人在研究开始就已经做过手术了,1995到2011年研究期间有1390名女性做了手术。在研究期间,511人死亡:333人死于乳腺癌,68人死于卵巢癌、输卵管癌和腹膜癌,其他的死于其他癌症。
研究人员还发现,平均在每五六年期间,有186名女性不仅患有卵巢癌,输卵管癌还有腹膜癌(腹部内层的癌症包括子宫)。
Narod团队报道,切除卵巢的女性患有卵巢癌的可能性降低了80%。携带BRCA1突变基因的女性推迟手术直到40岁的患有卵巢癌的可能性增加了4%,如果女性等到50岁才进行手术,可能性增加14.2%。这就是为什么在美国有70%的女性知道她们携带BRCA突变基因后选择切除卵巢。
但是,对只携带BRCA2突变基因的女性患有卵巢癌的可能性非常低可推迟到40岁才进行手术。在研究的这些女性中,只有1人患有卵巢癌。
研究人员同时发现在所有女性的一生中,包括那些没有BRCA突变基因的,患有卵巢癌的可能性只有1.4%。
总体来说,卵巢切除使任何原因引起死亡的可能性降低了77%,主要是降低了患卵巢癌、输卵管癌、腹膜癌和乳腺癌的风险。
手术的好处远远超过它的副作用
卵巢切除会给女性带来一系列的生理和心理问题,但研究员Narod指出:”手术的好处远超过它的副作用。这些副作用包括更年期症状,如更年期潮热和失眠,但通过荷尔蒙更换治疗均可以解决。其他的副作用可能包括心脏疾病风险略微增长,记忆力和脑力思维上的问题。”当然,切除卵巢意味着不会有孩子,但是在35岁之前女性应该有了家庭,Narod说。
研究人员还介绍,女性带有BRCA1或BRCA2突变基因患有乳腺癌和卵巢癌的风险更高,而卵巢切除可以将70岁前死亡的可能性降低77%。
另外,根据美国临床肿瘤学会一则最新消息,在女性确诊的疾病中70%的是死于乳腺癌。Narod团队却发现切除卵巢也能使携带BRCA1突变基因的女性患有乳腺癌的可能性降低48%。
去年电影明星安吉利娜•朱莉——也是BRCA1突变基因携带者,宣布打算切除她的卵巢。先前,她已做了双侧乳腺切除术,朱莉的母亲,女星玛奇琳•伯特兰德在56岁死于卵巢癌。
真正的挑战是让更多女性筛查BRCA突变基因
Narod强调:“真正的挑战是让女性筛查BRCA突变基因,大部分带有这些突变基因的女性并不知道她们有。可能300个人中只有1个人带有这些突变基因。”
“如果我们想要实现全面的效果,更多的女性能够进行检测是至关重要的。”Narod说,"基因检测越便捷意味着费用越低,由1000美元到100美元。"
纽约州的Manhasset北岸LIJ癌症研究所妇科肿瘤的副主任Andrew Menzin博士说,最新的研究“为干预治疗提供大力支持,帮助他们在生活的环境中决定怎么去做。”Menzin没有参加研究,但他建议有乳腺癌或卵巢癌家族史的女性应该经过她们初级保健医生的筛选。
基因检测不仅有医疗作用还包括其他影响,如它可以引起焦虑,它应该只可以被用来进行遗传咨询来解释结果,Menzin指出“它是医学科学和医学艺术的结合”。
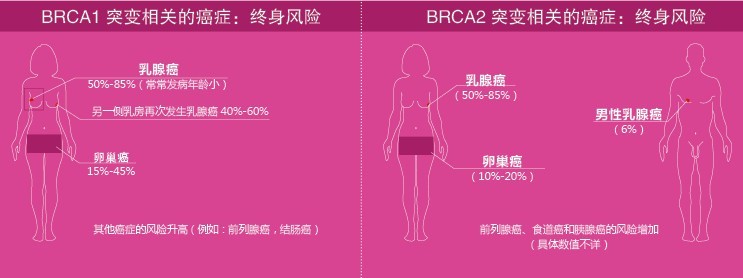
小知识:BRCA1/2基因突变与卵巢癌、乳腺癌
BRCA1、BRCA2全名分别为乳腺癌易感基因1(breast cancer susceptibility gene 1)和乳腺癌易感基因2(breast cancer susceptibility gene 2),发现于1990年和1994年,虽然是因为乳腺癌命名,但是它们与卵巢癌也有着密切的关系。
实际上,BRCA1/2是两种具有抑制恶性肿瘤发生的优良基因,在调节人体细胞的复制、遗传物质DNA损伤修复、细胞的正常生长方面有重要作用。如果BRCA1/2基因发生了突变,那么它所具有的抑制肿瘤发生的功能就会受影响,据统计,与BRCA1、BRCA2突变相关的癌症终身风险如下所示:
Impact of Oophorectomy on Cancer Incidence and Mortality in Women With a BRCA1 or BRCA2 Mutation
Purpose The purposes of this study were to estimate the reduction in risk of ovarian, fallopian tube, or peritoneal cancer in women with a BRCA1 or BRCA2 mutation after oophorectomy, by age of oophorectomy; to estimate the impact of prophylactic oophorectomy on all-cause mortality; and to estimate 5-year survival associated with clinically detected ovarian, occult, and peritoneal cancers diagnosed in the cohort. Patients and Methods Women with a BRCA1 or BRCA2 mutation were identified from an international registry; 5,783 women completed a baseline questionnaire and ≥ one follow-up questionnaires. Women were observed until either diagnosis of ovarian, fallopian tube, or peritoneal cancer, death, or date of most recent follow-up. Hazard ratios (HRs) for cancer incidence and all-cause mortality associated with oophorectomy were evaluated using time-dependent survival analyses. Results After an average follow-up period of 5.6 years, 186 women developed either ovarian (n = 132), fallopian (n = 22), or peritoneal (n = 32) cancer, of whom 68 have died. HR for ovarian, fallopian, or peritoneal cancer associated with bilateral oophorectomy was 0.20 (95% CI, 0.13 to 0.30; P < .001). Among women who had no history of cancer at baseline, HR for all-cause mortality to age 70 years associated with an oophorectomy was 0.23 (95% CI, 0.13 to 0.39; P < .001). Conclusion Preventive oophorectomy was associated with an 80% reduction in the risk of ovarian, fallopian tube, or peritoneal cancer in BRCA1 or BRCA2 carriers and a 77% reduction in all-cause mortality.






