脑淀粉样血管病是β-淀粉样蛋白选择性沉积于皮层和软脑膜中小动脉、微动脉及毛细血管引起的一种脑血管病。阿尔茨海默病主要是Aβ42沉积,而CAA主要是Aβ40沉积。
CAA在老年人中很普遍,是老年人发生自发性脑出血和认知损害的重要原因。CAA临床表现主要是反复颅内出血、认知受损和痴呆。中重度CAA患者更容易发生颅内出血,且与认知障碍和死亡风险升高相关。然而,CAA也可能完全无症状,特别是80岁以上的老年人。
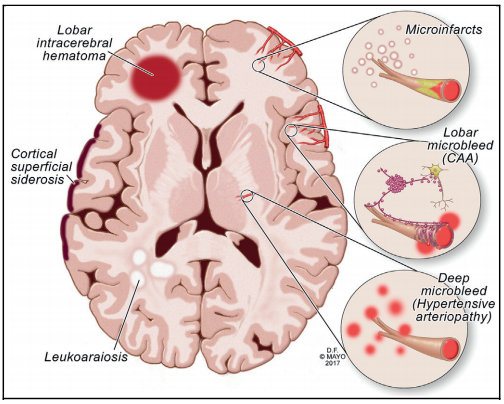
图1 老年人大脑中可见的CAA相关血管病变,包括脑白质疏松(leukoaraiosis)、皮层表面含铁血黄素沉积(cortical superficial siderosis,CSS)、脑叶出血(lobar intracerebral hemorrhage)、微梗死(microinfarcts)和脑叶微出血(lobar microbleeds)等;也可见深层微出血(Deep microbleeds),与高血压性动脉病变最相关。
二、脑淀粉样血管病的诊断
CAA的确诊需对脑组织进行病理检查,发现淀粉样蛋白沉积的证据。然而脑组织活检在老年人中的风险较高,因此我们需要一个不用对脑组织取样的临床诊断标准。Boston标准中可能的和有可能的CAA标准无需活检,诊断条件仅包括临床资料和影像学检查。CAA的影像学表现包括脑叶出血、蛛网膜下腔出血、脑微出血(cerebral microbleed,CMB)、皮层表面含铁血黄素沉积以及后部脑白质高信号等。
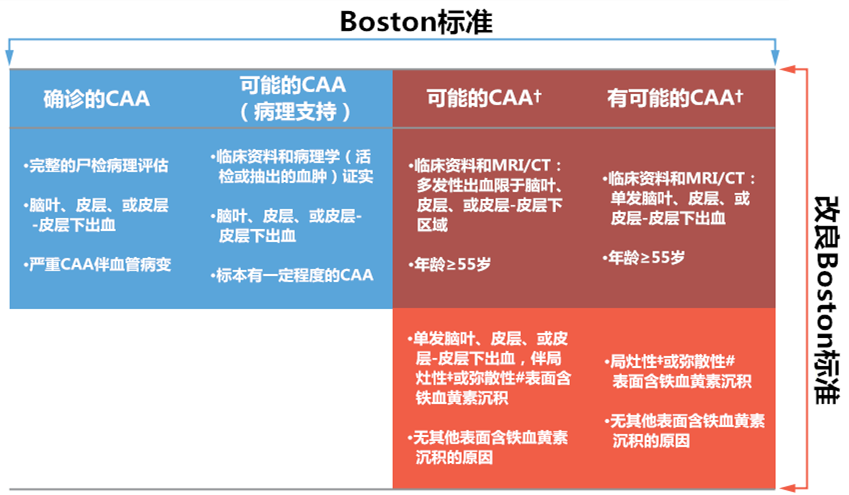
图2 CAA相关脑出血的诊断——Boston标准和改良的Boston标准
(†,无其他导致出血的原因;‡,含铁血黄素沉积≤3 sulci;#,含铁血黄素沉积≥4 sulci)
三、房颤合并CAA患者的临床管理
房颤患者的卒中发病风险随年龄增加而升高,50多岁时为1.5%,80多岁时升高到23.5%。老年房颤患者需积极预防卒中。然而,他们的脑出血风险也较高,特别是患有CAA者;既往有脑叶出血或其他脑出血高危影像学特征的人群中,脑出血风险特别高。因此,房颤合并CAA患者的抗凝治疗需更加慎重。
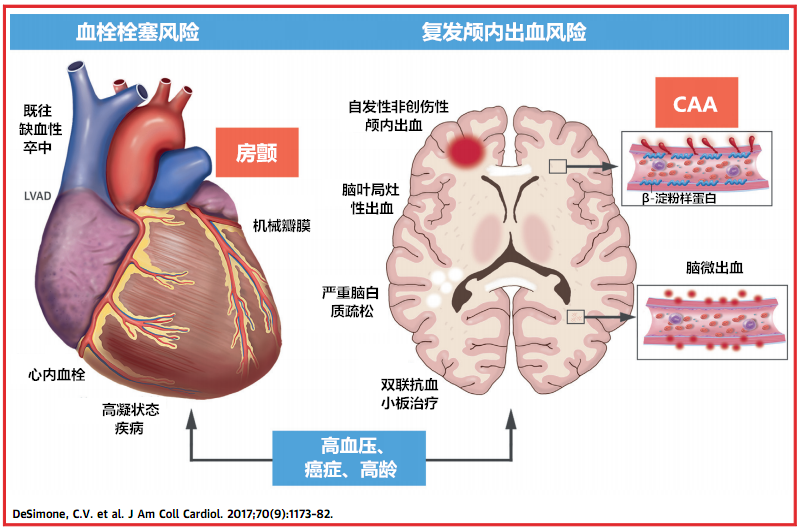
图3 CAA和房颤管理——血栓栓塞和颅内出血的危险因素
大多数华法林相关脑出血病例发生在INR在治疗范围内,因此紧靠严格控制INR对预防脑出血来说是不够的。多项证据支持潜在的血管病变与抗凝相关脑出血风险增加相关。尽管不作为常规推荐,但如果有可能,老年房颤患者在抗凝治疗之前应详细评估MRI。
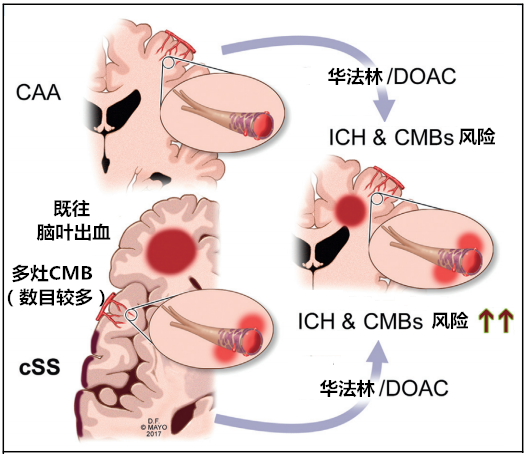
图4 颅内出血相关危险因素和潜在的管理策略
(DOAC,直接口服抗凝血剂)
既往脑出血患者的抗凝治疗风险评估仍缺乏足够证据支持。2016 ESC房颤管理指南建议,症状性脑出血或确诊CAA的房颤患者应避免口服抗凝治疗。但这一推荐仍有争议,因为越来越多的观察性研究证据表明脑出血后抗凝治疗可持续获益。然而,这些观察性研究缺乏足够的细节来描述脑出血患者中CAA的可能性。对这些研究结果的解读必须谨慎。
在大规模临床试验中,DOAC(达比加群、利伐沙班、阿哌沙班和依度沙班)治疗的脑出血风险较华法林更低。AVERROES试验亚组分析显示,阿哌沙班治疗的新发微出血数量与阿司匹林相似。然而,到目前为止,这些药物还未在有脑出血病史(特别是CAA相关脑出血)的患者中进行特殊观察,来评估脑出血复发风险。此外,只有达比加群具有已获批的特异性逆转剂(idarucizumab),可在脑出血时快速有效地逆转抗凝作用。多中心研究显示,接受DOAC治疗发生急性大出血(主要是胃肠道或颅内出血)的患者使用andexanet alfa可有效止血。
左心耳封堵(LAAO)是长期抗凝治疗出血风险较高的房颤患者的替代方案。CAA患者,特别是既往有脑叶出血或脑出血极高危标志物者(多发CMB/CSS),是LAAO的合理候选者。
房颤合并CAA患者的管理需要多学科团队紧密协作,包括心脏科(普通、介入和电生理)、神经科(包括卒中)和神经影像科医生,解决复杂问题,共同制定卒中预防策略。这种团队协作模式强调高度个体化、以患者为中心和共享决策。

图5 房颤合并CAA患者的药物及非药物治疗(心-脑团队多学科模式)
(*在出血高危患者中使用DOAC还需要进一步数据,但与华法林相比,DOAC的颅内出血风险较低)
总 结
在老年房颤患者的管理中,CAA是最容易被忽视的一个方面,目前的临床风险评分存在盲区。医生应提高对CAA的认识,努力降低颅内出血风险。在考虑抗凝治疗时,慎重权衡血栓栓塞和脑出血风险(包括CAA的可能性)。
文献:Christopher V. DeSimone, et al. Cerebral Amyloid Angiopathy: Diagnosis, Clinical Implications, and Management Strategies in Atrial Fibrillation. J Am Coll Cardiol 2017;70:1173–82





