陈功1,王屹2
1.中山大学附属肿瘤医院 结直肠科
2.北京大学人民医院 放射科
一. 背景:ESMO直肠癌指南
2017年7月20日,时隔四年后,ESMO在其官方杂志Annals of Oncology在线发表了2017版ESMO直肠癌临床实践指南。
众所周知,ESMO指南和NCCN指南是目前国际上最为著名、应用最广泛的两大癌症临床实践指南系统。就直肠癌而言,ESMO指南更是处处体现了精细化和个体化,从而受到业界同仁更多的认可,应用也更为广泛。
尤其是2013版ESMO直肠癌指南,首先提出了基于以"肛门指诊+直肠腔内超声+高分辨率盆腔MRI"联合一体的综合手段,来对直肠癌进行术前精准分期,然后基于肿瘤位置(距肛缘距离)、T分期、N分期、EMVI(肠壁外血管浸润)和MRF(直肠系膜筋膜)等因素来对直肠癌的局部复发风险进行分级,最后根据复发风险程度选择不同的治疗模式。
ESMO倡导的这种基于复发危险度的精细个体化治疗模式对于传统意义上的"局部进展期直肠癌"(LARC)(即分期>cT3或N+)具有更加重要的意义,对于LARC,目前国际主流治疗策略就是包括"术前同步放化疗+TME手术+术后辅助化疗"的"三明治式治疗",比如NCCN指南就推荐所有LARC接受"三明治式治疗",而ESMO指南将LARC进一步细分为不同亚组,避免了将所有LARC都进行术前治疗而带来的"过度治疗"问题,因此在临床上更加受到欢迎,应用更加广泛。
2017版CSCO(中国临床肿瘤学会)直肠癌指南就更加采用了贴近ESMO理念的诊疗策略。
那么,2017版的ESMO直肠癌指南的精髓又是什么?和2013版有什么变化?
二. 诊断检查
此部分内容与2013版无重大变化,详见表1.
依然强调以"肛门指诊+直肠腔内超声+高分辨率盆腔MRI"联合一体的综合检查手段。
在判断"括约肌浸润"时增加了"麻醉下检查"的选择,这一点似乎临床可操作性不强;
在M分期检查中,删除了"胸片"的选项,这一点我个人十分赞同,事实上在我们临床实践中也是很常见的问题,还有很多地方也许考虑到经济问题,对于结直肠癌的术前评估,胸部检查往往选择胸片,其实这是很不够的,因为肺是结直肠癌第二好发的转移器官,而且,原发性肺癌的发病率增长很快,因此,在基线时候,应该尽可能选择CT作为胸部的评估手段。

在M分期检查中,2017版还增加了"如果广泛存在EMVI,针对其他部位行PET-CT"选择,也是可以理解的。由于EMVI是发生远处转移的很强烈的预测信号,当盆腔MRI提示广泛存在EMVI时,PET-CT是有助于发现那些肝肺以外的转移的,比如骨转移。
三. 术前危险度评估
与2013版相比,2017版指南既延续了较多的原来理念,又做了一定程度更新,详见表-2,具体内容如下:
1)与2013版相同的:
-盆腔风险评估的参数:
肿瘤距肛缘的距离、T分期、N分期、EMVI、MRF、侧方淋巴结状态。
-评估手段:
依然是高分辨率MRI、直肠腔内超声、直肠指诊
-T3亚组:
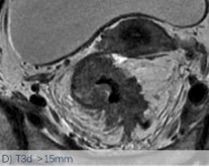
依然采用了2013版的方法,该分类法是基于英国MRC的MERCURRY研究所确立的标准,基于治疗前高分辨率MRI下、按照原发肿瘤突破肠壁固有肌层后侵入直肠系膜内的垂直距离来区分,按1mm,1-5mm,6-15mm,>15mm将T3分为a、b、c、d四个亚组。(图1:A, B, C, D)
该分类法与北美放射学会的三分法有所不同,后者按<5mm,6-10mm和>10mm分为a、b、c三个亚组。在具体的临床实践中,也许北美的分类法更实用,因为在MRI上要甄别<1mm的肿瘤浸润是有客观困难的,而在新版的ESMO指南中,事实上T3a/b的治疗差异基本不存在了,因此,临床实践中也不太需要影像科医生去鉴别T3a和T3b了。
图-1: MRI的T3亚分期(A, B, C, D)如下:
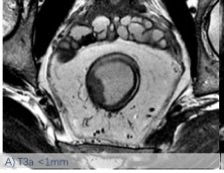
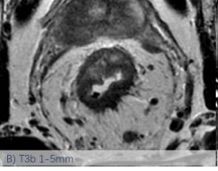
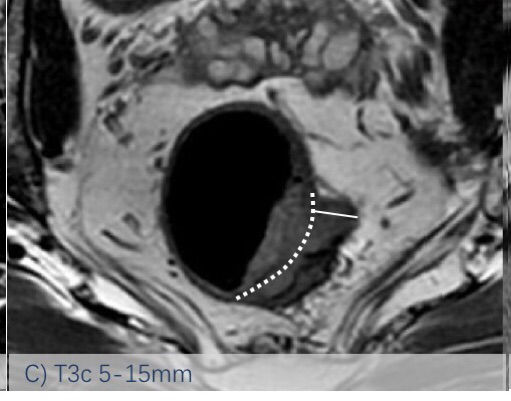
图C示MRI影像片上测量T3浸润深度的示意图
-EMVI(壁外血管侵犯)
MRI中直肠癌EMVI的影像诊断标准源于Mercury 小组的研究结果。 高分辨MRI,特别是T2加权图像(T2 weighted imaging, T2WI)被用于诊断直肠癌EMVI。
正常情况下,直肠壁外较大的血管呈匍匐状分布,这些血管在T2WI上由于血管内血液流动造成信号缺失亦称为流空现象。当直肠壁外血管管腔扩大,外廓不规则且流空现象消失为肿瘤信号代替,即可诊断为EMVI。
另外,较小的血管一般垂直穿入肠壁,当肿瘤直接浸润小血管根部,造成血管腔增宽时,同样可以诊断为EMVI。为了更为准确的判断EMVI,根据肿瘤外形,肿瘤周围是否存在血管,受累血管管径、轮廓及信号的变化,MRI评估直肠癌EMVI的5级评分系统,并将评分为0-2定义为阴性,3和4的定义为EMVI阳性(表2,如图2: A,B,C,D,E)

图-2: EMVI在MRI上的判断标准如下:
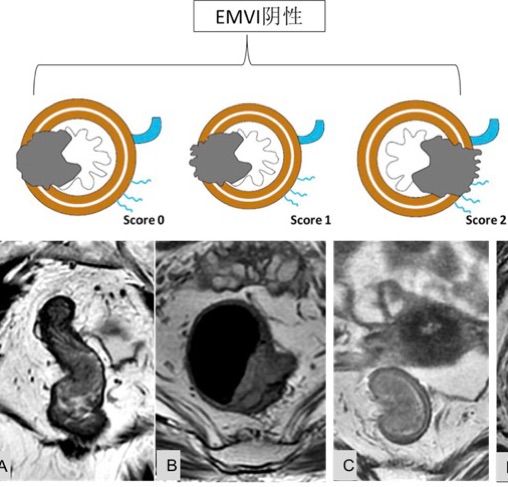
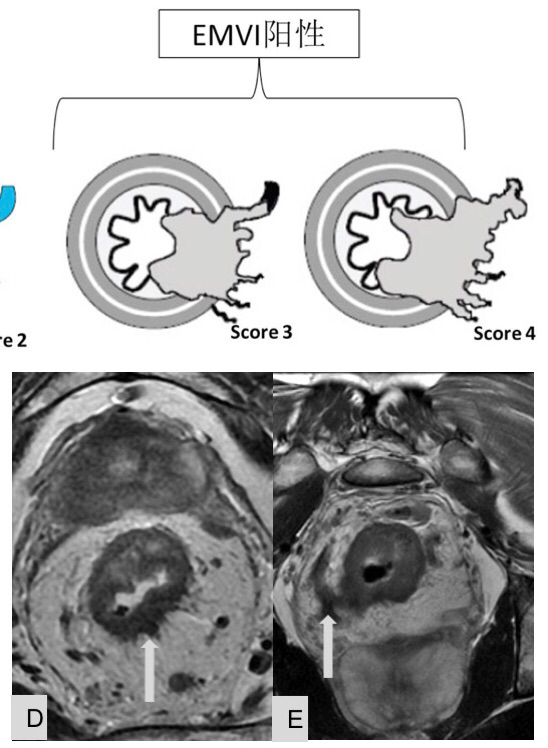
图D、E箭头所指处为EMVI阳性
-盆腔危险度分级:
仍然采用分级描述的方法,分为极早期(极好)、早期(好)、中期(中)、局部进展期(差)和晚期(极差)5个等级,其中极早期、早期和晚期与2013版完全相同。两个版本的对比详见表-3
2)与2013版不同的:
2013版指南M0直肠癌的盆腔危险度分为4个级别,极早期(极好)、早期(好)、中期(差)和晚期(极差),2017版最大的变化就是将2013版的"中期(差)"组(极低位cT2, cT3且MRF-(除非中高位cT3a/b直肠癌),N1-2,EMVI+,局限性cT4aN0)进一步分为两组:中期组(中)和局部进展期组(差)。
详细来说,就是将2013版里"低位cT3a/b,肛提肌-,MRF-,中高位cT3a/b,cN1-2(非结外种植),EMVI-"的患者列为2017版的"中期组(中)",而仅将"cT3c/d或极低位,肛提肌-,MRF-;中位cT3c/d,cN1-N2(结外种植),EMVI+,局限性cT4aN0"的患者仍然保留在"局部进展期组(差)"之列。
由上述可以看出,低位cT3a/b但肛提肌-且MRF-,以及伴有cN1-2的中高位cT3a/b肿瘤,没有EMVI,具有上述特征的直肠癌,2017版指南的更新主要就是调低了这部分患者的"盆腔局部危险度",从2013版的"差"调为"中"。
另外一个更新是在2013版指南中将"极低位直肠前壁的cT2肿瘤"的危险度分为"中期组(差)",而在2017版指南中取消了该特殊亚组,但用MRF来限制:只要MRF-的cT2肿瘤均列为风险度"早期组(好) "。
那么,2013版为何将极低位(腹膜返折下方)前壁的cT2肿瘤列为风险级别"差"并推荐术前治疗的呢?这得从直肠及其系膜的解剖特点说起。直肠系膜由疏松的结缔组织构成,位于直肠的后方,其内富含淋巴、血管组织,外表覆盖一层盆脏筋膜,从直肠后方、两侧三个方向包绕直肠,以后方的系膜最厚,约数厘米。
在腹膜返折上方的直肠,前壁是浆膜直接覆盖着浆肌层,没有系膜成分,进入腹膜返折下方以后,没有了浆膜层,在后方和两侧的直肠系膜也逐渐减少并在盆地肌层面完全消失,而在腹膜返折下方的直肠前壁,由于与精囊腺前列腺(男性)及阴道后壁(女性)相邻,直肠系膜也是很薄的,与体型有关,肥胖者,前壁会有一些脂肪覆盖,构成前壁的直肠系膜,但与后方相比,系膜的厚度也是要薄得多,要是在体型清瘦的患者,前壁则几乎没有脂肪形成的系膜,肠壁固有肌层外面就是前盆腔的泌尿/生殖器官,之间几乎就没有间隙。
因此,在2013版指南中认为此时对于深T2(deep T2,也即浸润至深肌层的T2),目前的影像学检查是很难与T3a鉴别,而对于前壁,本身直肠与前方泌尿/生殖器官的间隙就很小,此时达不到阴性CRM要求的>1mm是很有可能的,也即这些患者MRF是有潜在受累风险的,因此,主张行术前治疗。

而2017版指南,将cT2肿瘤均放入"早期组",但加入了一个限制条件,即MRF-,那么,对于2013版里所提及的需要术前治疗的前壁cT2肿瘤,事实上就是MRF高危受累的那部分肿瘤,从这个角度看,两个版本对此的规约还是一样的。
四.基于风险度分层的M0直肠癌治疗模式:
1.未曾改变的治疗原则:
关于M0直肠癌的治疗策略,ESMO指南的一个核心理念就是基于复发危险度的精细个体化治疗模式,尤其是术前治疗(SCPRT或CRT)的适应证更是与危险度密切相关,基本原则就是极早期(极好)组以局部切除为主要治疗,早期(好)组以根治性手术(TME)为主要治疗,局部进展期(差)组以"术前治疗[SCPRT或CRT]+TME手术"为主要治疗,晚期(极差)组以"CRT+TME手术"为主要治疗,只要采用了术前新辅助治疗的患者,均应考虑cCR问题,一旦获得cCR,可以考虑"观察等待"的非手术治疗策略。
在这个策略里还可以看出一条主线:越早期的疾病越不需要术前治疗,ESMO指南里似乎把术前治疗限制于"差"和"极差"这两组中;另外一条主线就是在术前新辅助治疗模式选择中(CRT对比SCPRT或单纯化疗),MRF是否阳性是关键,MRF+者需要CRT,MRF-者则可以选择SCPRT或单纯化疗,因为前者需要肿瘤退缩来将阳性的MRF转化为阴性。
2013版指南很好的体现了上述治疗原则,那么2017版也大同小异,完全延续了上述治疗策略与原则。
2. 2017版更新的治疗原则:
很显然,2017版与2013版治疗模式的区别主要就在于上述危险度分级的差别所致。在危险度分级中,多设立了一个"中期(中)组",将2013版中部分"局部进展期(差)组"患者划列为该组,治疗推荐以直接TME手术为主,只有在外科无把握做到高质量TME手术时考虑术前治疗。因此,依然维持了只有危险度"差"以上患者才需要术前治疗的基本原则。
正如在2017版指南中解释的一样,做出这些改变是因为一来术前基于MRI的淋巴结分期是不准确的,二来只要MRF-的cT3a/b,高质量TME手术后的局部复发率是极低的(<5%),因此,按传统标准那样对所有"局部进展期直肠癌(LARC)"(>cT3或N+)直肠癌进行术前新辅助治疗,上述部分患者获益仍然是未知的,考虑到治疗的毒性,尤其是肠道和泌尿生殖系统的功能损害问题,2017版指南下调了术前治疗的适应证。
简言之,在2017版ESMO直肠癌指南中,传统意义上的LARC中,符合下列条件者不再推荐术前治疗,可以直接行TME手术: MRF-、EMVI-的低位cT3a/b、中高位cT3a/b且cN1-2直肠癌。需要强调的是,对于这部分患者,外科医生有义务去判断能否做到高质量TME手术,这是关键。
五. 术后放化疗的推荐
与2013版指南比较,2017版指南对这个话题给出了详细的推荐,基于各种没有做术前治疗给出了术后放化疗必要性和证据的充分性,详见表-4,很有临床实用性,对于我国的临床实践意义尤其重要,因为目前我国局部进展期直肠癌接受术前CRT的比例还是远远不足。
新版指南强调,传统上对未接受过术前治疗的全部pT3-4或pN+直肠癌患者常规进行术后CRT,以期降低术后局部复发,对于高质量的TME手术,这种治疗模式备受争议。因此,新版指南详细列出各种疾病特征,然后对术后CRT给出了"充分且必要"、"充分"、"边缘充分"和"不充分且不必要"一共四种推荐。
从该推荐可以看出,在术后CRT决策中最重要的三个参数:TME手术质量、CRM状态、肿瘤距肛缘的距离。而且整体的术后CRT推荐适应症要严格于术前治疗的适应症,主要原因一是术后分期精准,更重要的是术后CRT的毒性要显著增加。比如,只要肿瘤位于腹膜反折上方(中高位),做到高质量TME手术,即便pT4a(肿瘤应该位于前壁),也不主张术后CRT的。
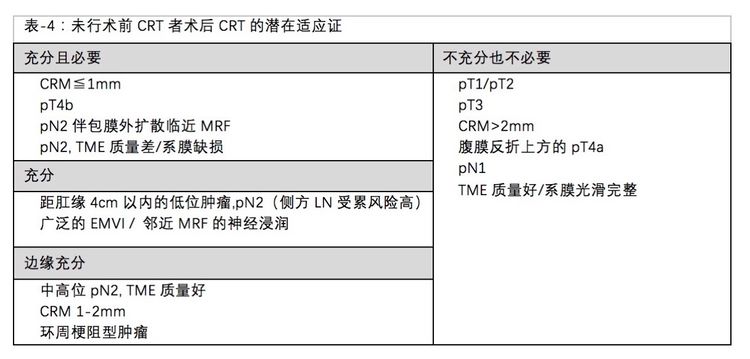
但需要强调的是,这一点提醒我们外科医生,如果一个直肠癌患者需要放疗,那就应该术前做而不是术后做,而切不可错误理解成术后CRT的的适应症较术前更窄,因此,抱侥幸心理先去做手术,这是万万不可取的。
六. M1直肠癌治疗模式
同时性M1期直肠癌,由于存在直肠原发瘤局部治疗和远处转移瘤全身治疗的问题,临床决策时具有相当的矛盾和困难,因为可能顾此失彼,对局部原发瘤控制较好的CRT,由于同步使用的全身化疗药物和剂量对远处转移瘤的控制是远远不够的,反之亦然。而关于这一特殊领域,NCCN指南几乎没有特别的指引,直肠mCRC与结肠mCRC的治疗指南几乎完全相同。
2013版的ESMO直肠癌指南做出了突破性的贡献,对于同时性直肠mCRC的治疗,除了遵循结肠mCRC的所有治疗原则外,关于原发瘤和转移瘤的治疗顺序问题,应先接受局部治疗然后接受全身治疗还是按相反的顺序治疗,强调应该在MDT(多学科综合讨论)中决策,主要决策原则是对患者身体威胁最大的病灶优先处理,然后综合这些原则,将同时性直肠mCRC分为如下三种临床情形,并给出相应的治疗建议:
a)原发性肿瘤和转移灶都可以初始手术切除,可以先采用5 × 5 Gy的方案对原发性肿瘤和受累的邻近淋巴结放疗,然后采用联合化疗,约3个月后手术切除转移灶和原发性肿瘤。
b)原发性肿瘤是局部晚期(很差)且转移灶可手术切除,可采用上述治疗策略,即采用短程放疗,11-18天后开始联合化疗,与采用氟尿嘧啶类的放化疗相比,这会导致全身治疗的剂量强度升高。放疗结束至少5到6个月后,行原发灶的手术治疗。
c)转移灶无法切除,需要缩小后再择期手术,同样可采用与上述相同的策略。另外,也可以先开始联合化疗,定期评价,继续化疗,直到肿瘤充分消退。然后,如果需要,可给予5 × 5 Gy的放疗,进行肝脏/直肠癌的同期或分期手术。
从2013版指南中可以看出,如果直肠mCRC患者的原发瘤需要局部控制,那么"SCPRT(即5X5短程放疗)+全身化疗"是指南推荐的主要治疗模式,因为该模式中SCPRT不会影响到全身治疗的开展,包括开始治疗的时间及剂量强度,而在SCPRT结束后进行为期数月的全身化疗,对于原发瘤等同于是延迟手术,有证据表明此时原发瘤也会有类似于CRT的肿瘤消退发生。
而对于直肠局部控制最好的CRT,指南特别强调指出"值得注意的是,(采用氟尿嘧啶类的)传统放化疗几乎从来都不适合作为同时性转移灶的一线治疗",主要原因就是传统CRT需要5个星期,而这个过程中由于仅采用氟尿嘧啶类单药作为放疗增敏的化疗,显然,这对于远处转移瘤的全身控制是远远不够的。
2017版指南,总体上延续了2013版的治疗原则,如果需要局部控制,依然强调了"SCPRT+全身化疗"的模式,但在细节上删除了上述a、b、c三种临床情形的具体描述,这一点,笔者觉得是个小小的遗憾,虽然总体原则没有变化,但2013版的三种具体临床情形描述还是对临床有一定指导意义的,临床实践中可以将患者"对号入座"来简单进行治疗决策。
在该类患者的治疗中,从ESMO指南推荐可以看出来,局部和全身兼顾是主要治疗原则和思路,而传统CRT之所以不被指南推荐,主要是全身化疗强度不够,而在欧美国家,目前是不主张在长程放疗中同步联合方案全身化疗的,一来考虑耐受性,二来,在LARC领域探索的每周一次的奥沙利铂应用并未提高疗效。
而对于这一点,我国的临床实践一直有不同声音,在笔者所在的中山大学肿瘤医院以及上海的复旦大学肿瘤医院,对于局部进展期直肠mCRC,目前这两个单位依然在采用几乎全剂量强度的联合方案(CAPEOX或mFOLFOX6)同步长程放疗(23-25F/5周),联合化疗的给予方法与单纯全身化疗完全相同。
而这样的治疗模式我们并未观察到很大的毒性,制药不是身体衰弱者,基本能完成计划的治疗,疗效分析显示既达到了良好的原发瘤局部控制,转移瘤也得到类似标准全身化疗的疗效。
七. 结语
这就是2017 版ESMO直肠癌临床实践指南最核心的更新内容,总体而言,在整体延续了2013版指南的主要治疗原则情况下,对局部进展期直肠癌根据危险度进一步细化分层,对MRF-的患者,收缩了术前放化疗的适应证,扩大了直接TME手术的适应证,在精准化分层治疗上更进了一步,相信会受到临床医生的欢迎,期望最后能改善临床实践结局。
附录:
2013版ESMO直肠癌指南:Annals of Oncology 2013; 24(suppl 6): vi81-vi88
2017版ESMO直肠癌指南:Annals of Oncology 2017; 28(Suppl 4): iv22iv40,





