徐建明教授首先介绍道,CRC领域的国际进展十分迅速,本年度CRC有太多的进展和更新,需要我们及时进行学习、探讨。本次报告将以5个方面简单和大家交流一下本年度CRC的热点问题。
辅助治疗
辅助治疗中不得不提的就是本次ASCO和ESMO上均有汇报的IDEA研究。由于含奥沙利铂方案的神经毒性较大,全球开展了6项多中心的非劣效临床研究。目的为了探究Ⅲ期结直肠癌患者辅助治疗中,6月 vs 3月奥沙利铂为基础的辅助化疗在疗效与安全性的差别。
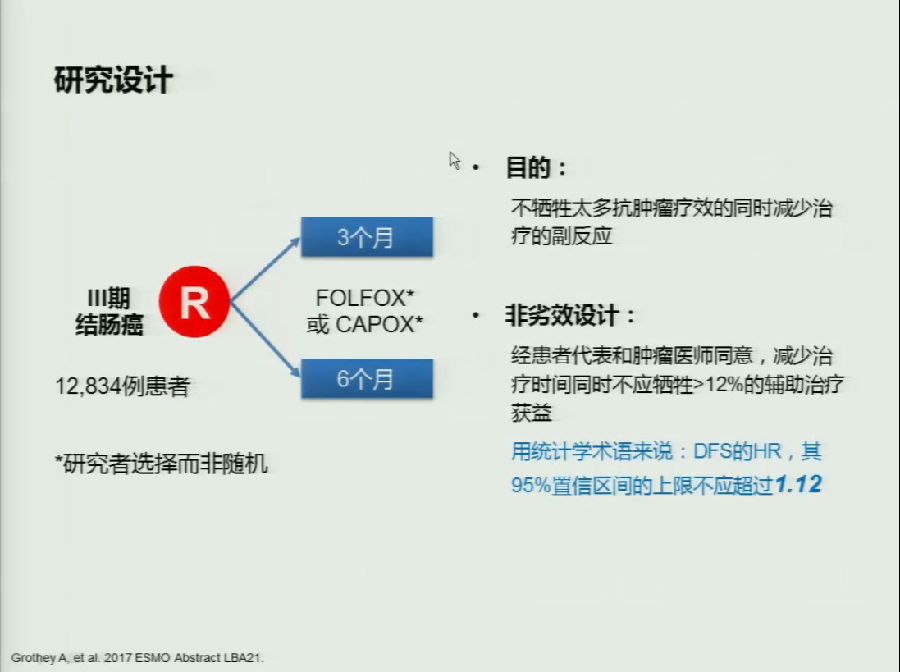
设定无病生存期(DFS)的HR其95%CI上线不超过1.12为达到非劣效标准,证明3月辅助化疗不劣于6月辅助化疗。
最终结果表明,3月、6月辅助治疗两组的3年DFS分别为74.6%和75.5%,HR为1.07(95%CI, 1.00-1.15)。95%CI的上限超过了1.12,总体来看结果是“失败”的。
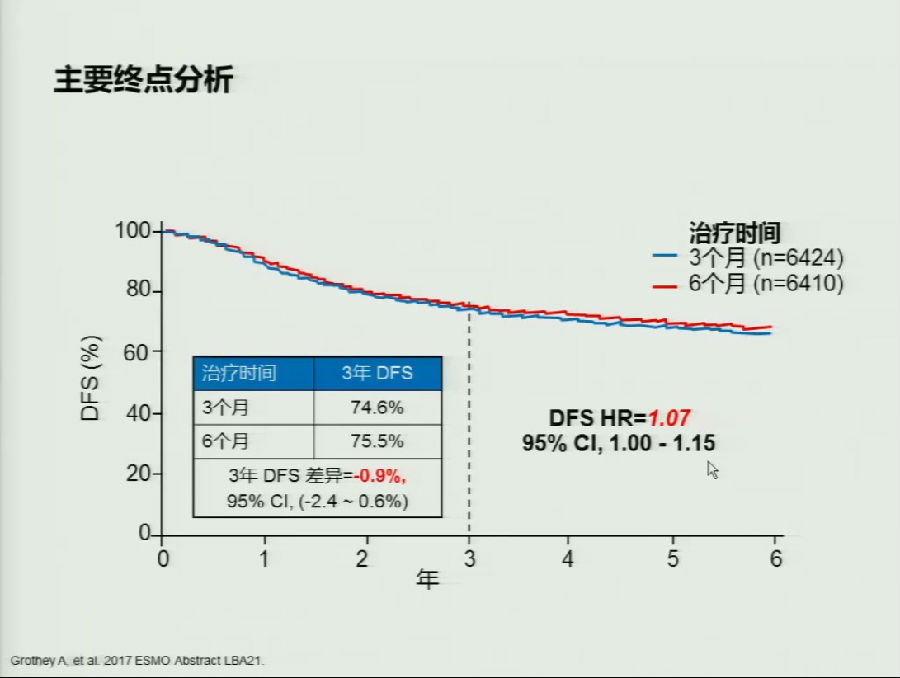
但是亚组分析表明,T1-3 N1的患者达到了非劣效终点,而对于T4和/或N2的患者来说总体预后上存在较大差异,未达到研究终点。另外,CAPOX和FOLFOX两亚组之间也有一定差异:CAPOX方案可能略优于FOLFOX方案,但是尚存争议。

整体来看,根据目前的IDEA研究结果,结直肠癌患者的辅助治疗方案策略可归纳为如上的表格。
RAS野生型mCRC的治疗模式
近期,RAS野生型mCRC治疗也有一定的数据更新,西妥昔单抗和贝伐珠单抗之争也愈发激烈。目前,对于RAS野生型左半mCRC患者来说,治疗模式已有多种序贯模式的选择。
那么,这么多的治疗方法,该如何选择呢?徐建明教授举了两个临床研究的例子作为参考。
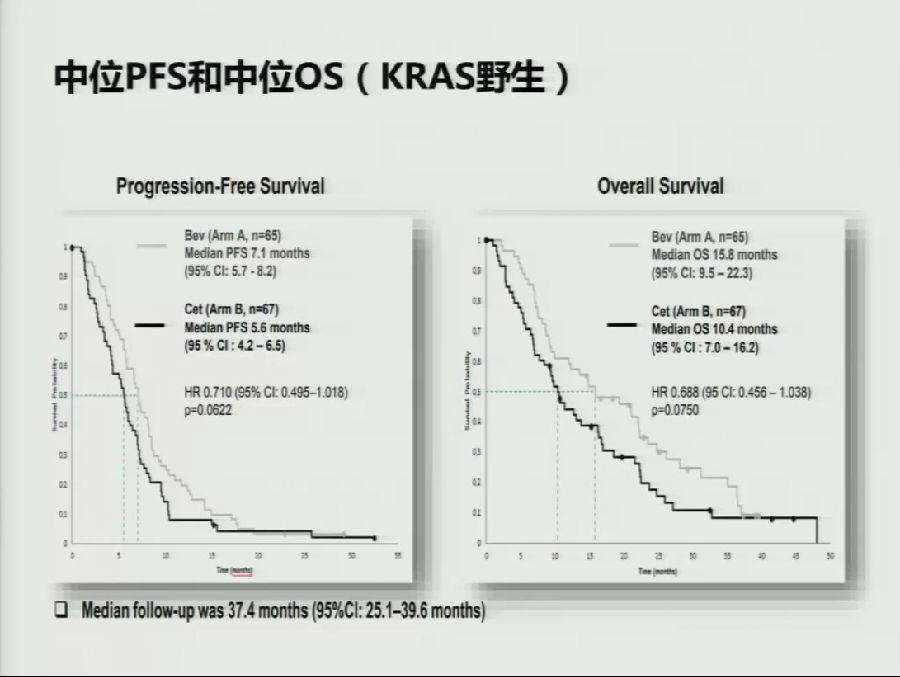
第一项研究为PRODIGE 18研究,探究在KRAS野生型的mCRC患者中,一线应用贝伐珠单抗联合化疗后,跨线应用化疗联合贝伐珠单抗 vs 换用西妥昔单抗的疗效差异。
结果表明,在KRAS野生型患者中,二线跨线应用贝伐珠单抗无论在PFS(HR, 0.710; P=0.0622)和OS(HR, 0.688; P=0.0750)的数据上均高于换用西妥昔单抗,差异均无统计学意义。
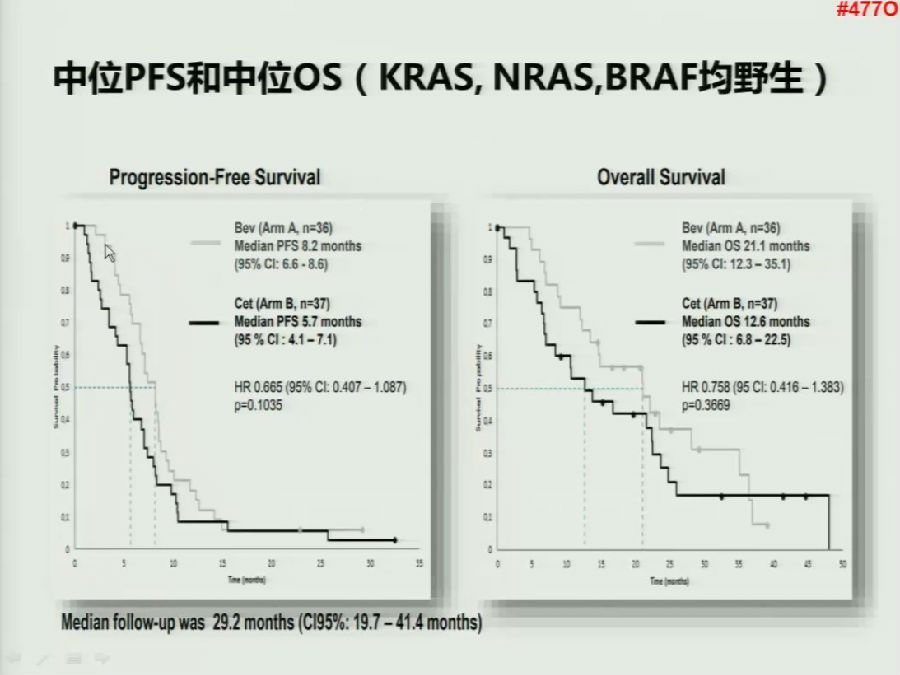
令人惊讶的是,无论是在KRAS野生型患者基础上,加上NRAS野生,或者再纳入BRAF野生型的病人,患者的PFS和OS数据也均得到了相同的趋势。
在另外一项研究Spiritt中,既往应用贝伐珠单抗治疗的患者跨线应用贝伐珠单抗也在数据上优于二线应用帕尼单抗,差异无统计学意义。
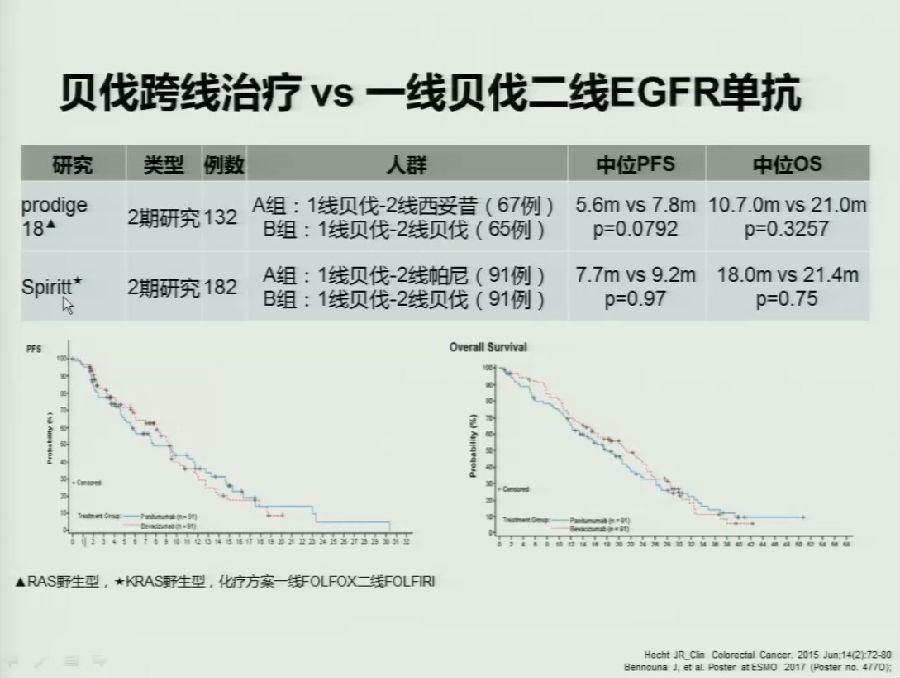
有基础研究表明,这可能换用EGFR单抗后VEGF通路调节发生改变有一定关系,但是跨线应用贝伐珠单抗也尚存一定争议。
在既往应用FOLFRI联合西妥昔单抗的mCRC患者中,跨线应用西妥昔单抗+FOLFOX或单用FOLFOX方案也开展了临床研究。
该研究也得到了无统计学差异的结果,全组患者中跨线应用西妥昔单抗提高的生存获益有限。
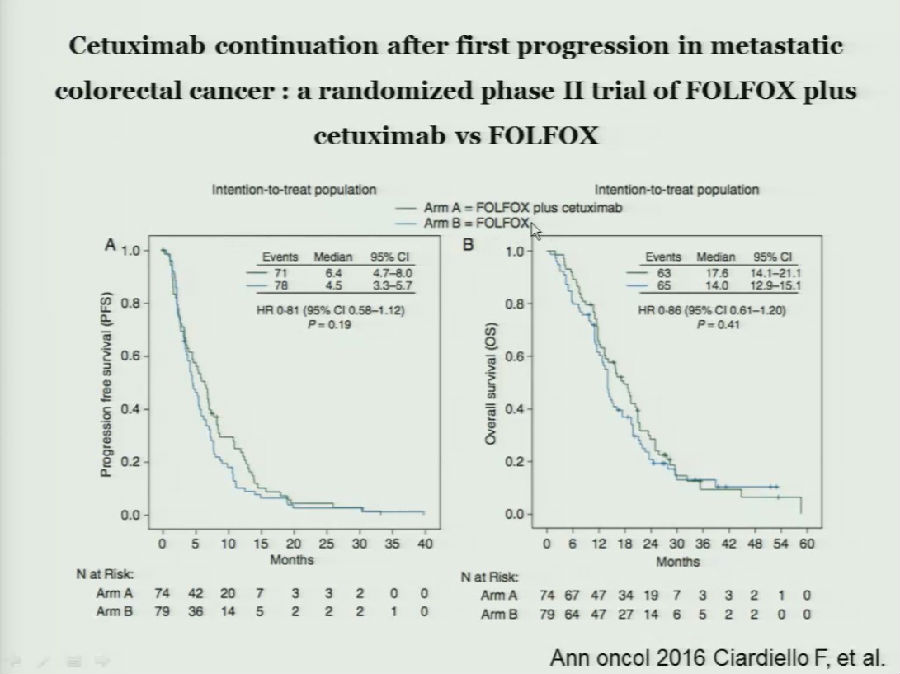
而在KRAS/NRAS/BRAF/PIK3CA均野生的亚组中,跨线应用西妥昔单抗,患者的生存获益更为明显。
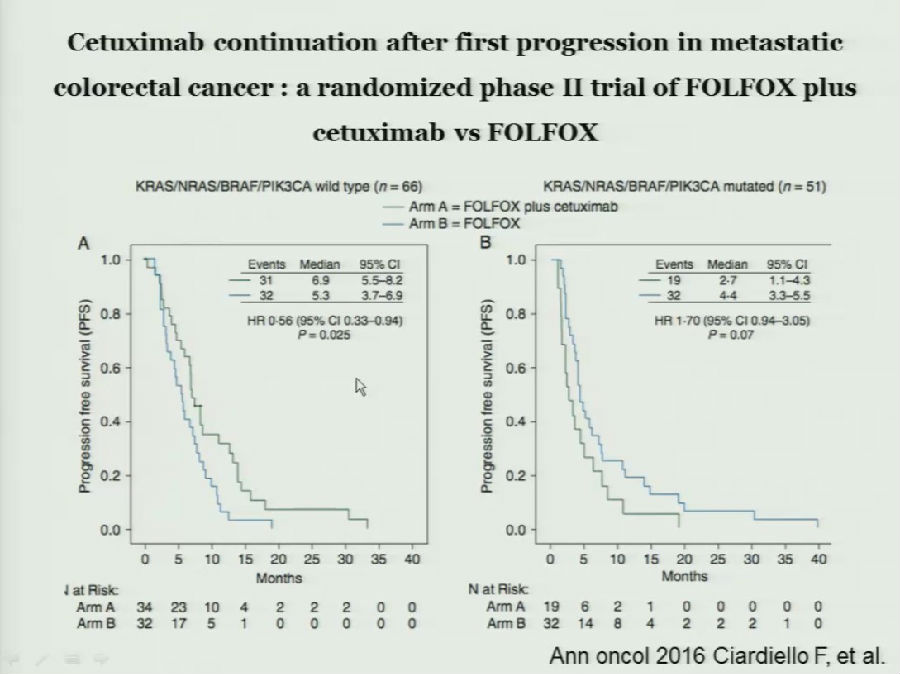
徐建明教授指出,一线经过含西妥昔单抗治疗后,其耐药机制比较复杂。他和他的研究团队开展的一项临床研究表明,一线应用西妥昔单抗治疗后,KRAS突变占获得性耐药突变的25%,PIK3CA占23%,另外还有多种例如AKT-1,PTEN等耐药基因的突变。
另外,也有研究表明一线应用西妥昔单抗耐药后,三、四线再应用西妥昔单抗有效的临床研究发表。所以,西妥昔单抗的二线治疗也有待商榷和进一步探讨。
在结直肠癌患者的治疗中,我们不应该听取“一面之辞”,而是要综合考虑进行不同治疗策略的选择(如下图)。
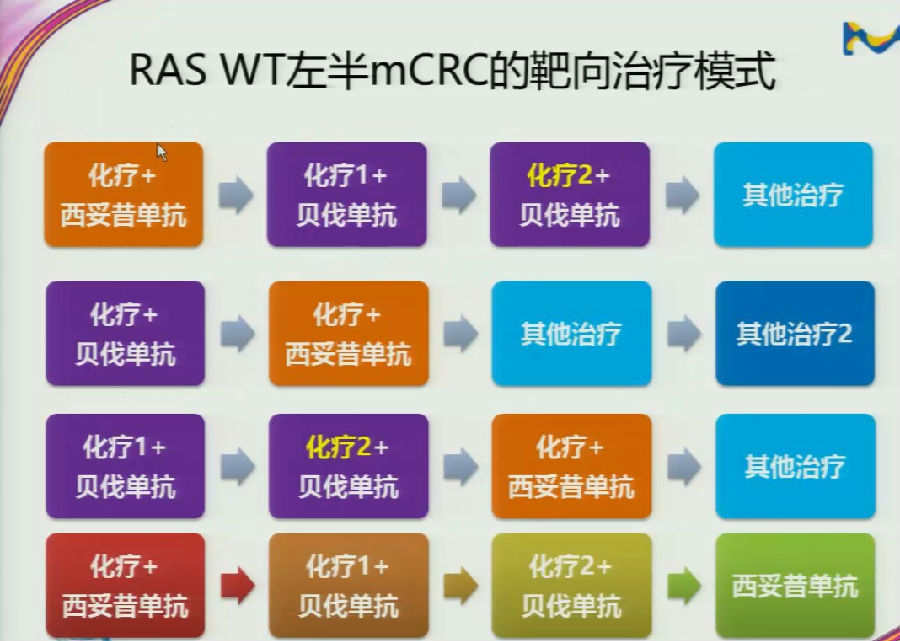
例如,对于RAS左半mCRC患者来说,如果有望通过系统治疗达到R0切除,可能第一种治疗选择更佳;
如果患者减轻重量负荷后进行手术的希望不大,可能第三种治疗模式为更好的选择。
BRAF突变的肠癌
一开始,2015年Ann. Oncol.上发表的研究首先发现BRAF V600E突变/非V600E突变的预后可能十分不同,但尚需大样本验证。
随后,来自3个中心的大样本临床研究表明,BRAF V600E突变患者的预后明显差于BRAF野生型、BRAF non-V600突变患者的预后。
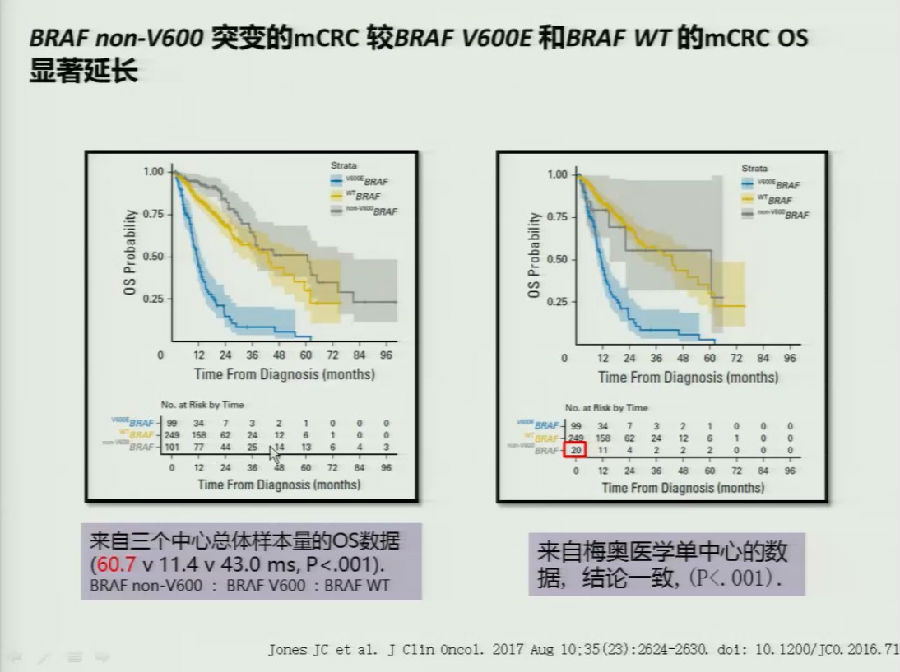
这可能是由于BRAF V600E突变肠癌的生物学行为完全不同有关。首次在BRAF突变患者中做尝试的BRAF抑制剂Vemurafenib得到了较低的有效率(在黑色素瘤中的ORR:81%,在mCRC患者中的ORR:5%)。
由于BRAF突变会引起旁路MEK通路的激活,目前BRAF抑制剂联合MEK抑制剂治疗联合或不联合西妥昔单抗的临床研究正在开展,达到了不错的疗效。
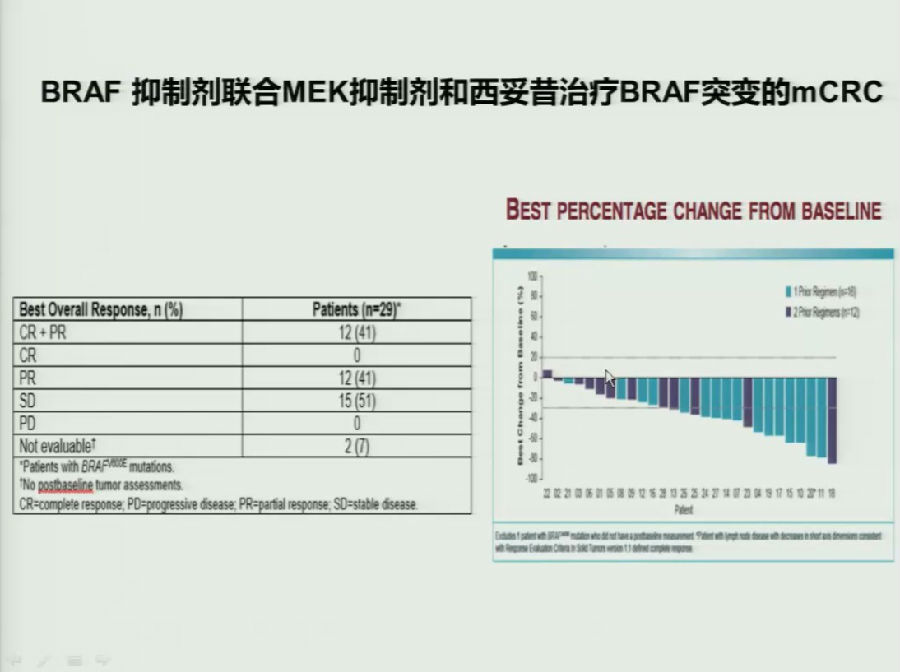
目前,FOLFOXIRI+BEV/CET仍为标准治疗方案,BRAF抑制剂+西妥昔单抗+伊立替康也可能是较好选择。未来,BRAF抑制剂+MEK抑制剂(联合或不联合西妥昔单抗)可能成为最优选择。
免疫治疗
现在,Nivolumab和Pembrolizumab都被FDA批准用于既往接受过氟尿嘧啶、奥沙利铂、伊立替康治疗的dMMR结直肠癌患者。
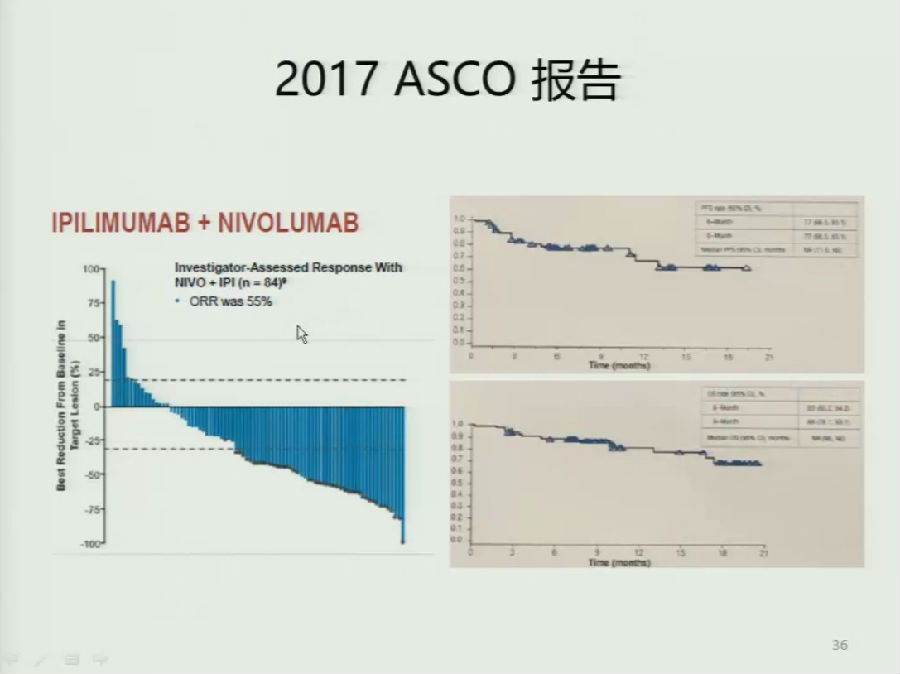
今年ASCO主要更新的为Nivolumab联合Ipilimumab的Checkmate-142研究。结果表明联合治疗的ORR较单药Nivolumab有一定的提升,但是毒性也显著增大。
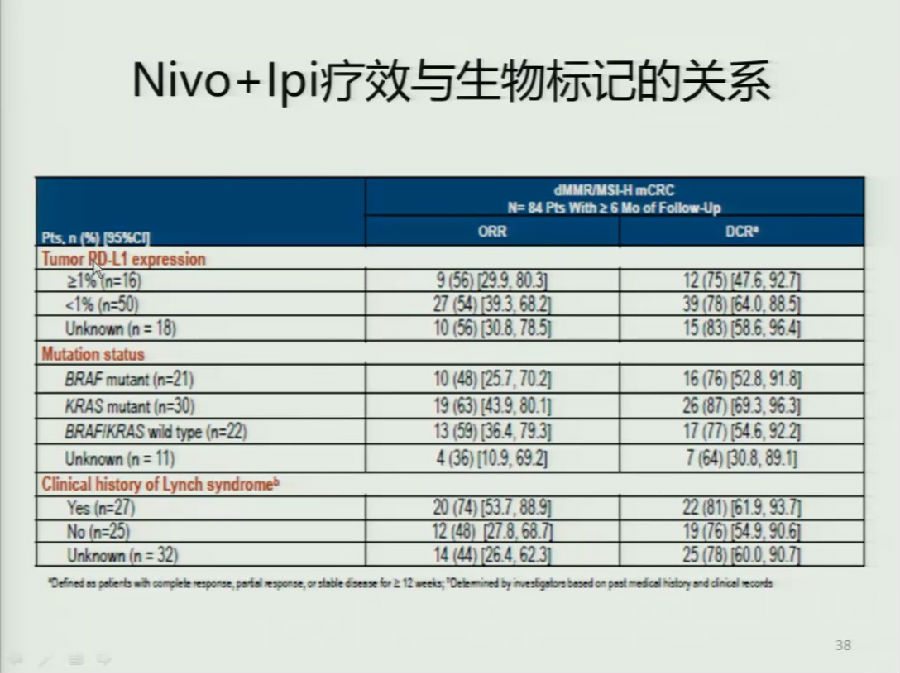
ESMO上又进一步对该研究的患者特征进行二次分析。结果表明,BRAF突变患者和林奇综合征患者应用Nivoluamb和Ipilimumab的有效率较高。
CMS的临床价值
2015年CRC的CMS分型首先在Nature上发表,将结直肠癌分为CMS1-4型,不同CMS亚型有不同的生物学特征,详细见下图。
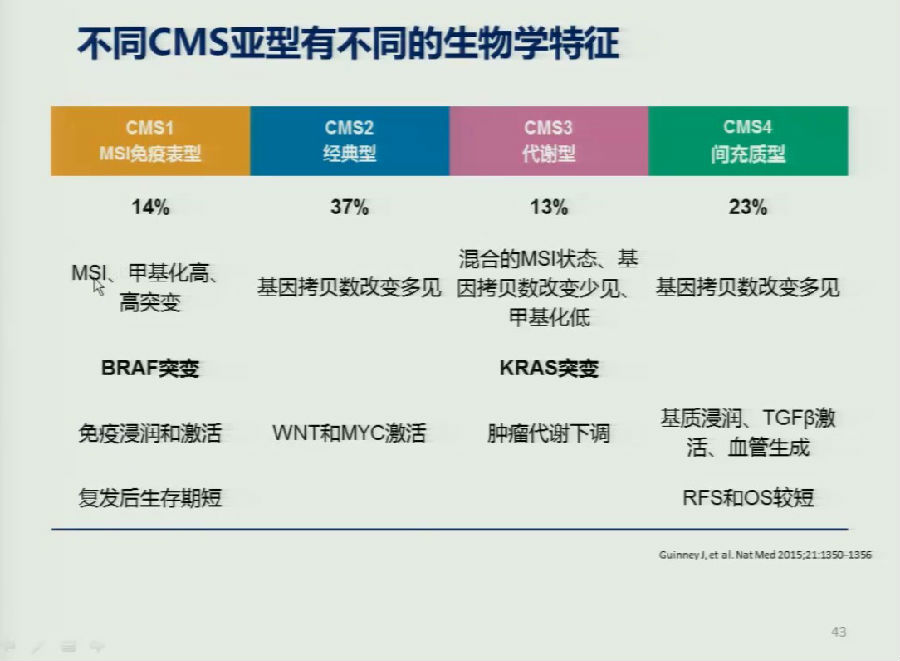
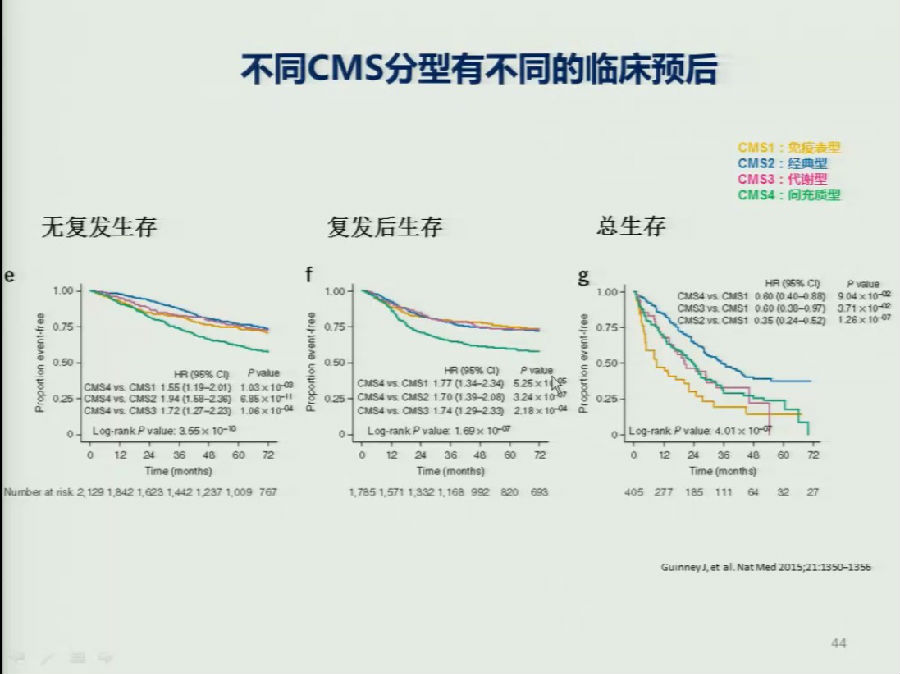
一开始的研究表明,总体来看CMS2型患者的预后更好,CMS1型的预后较差。但是该研究有一定的缺陷,那就是对Ⅳ期肠癌入组的患者过少,可能影响CMS分型对预后判断结果的准确性。
于是在今年的ASCO和ESMO上,欧美的研究团队又对AGITG MAX,FIRE-3,80405等经典晚期肠癌研究中探究CMS分型的价值,从中得到了一些数据更新的结果:不同亚型在各研究中比例大致相同,右半肠癌CMS1型较多,左半CMS2型为主等。
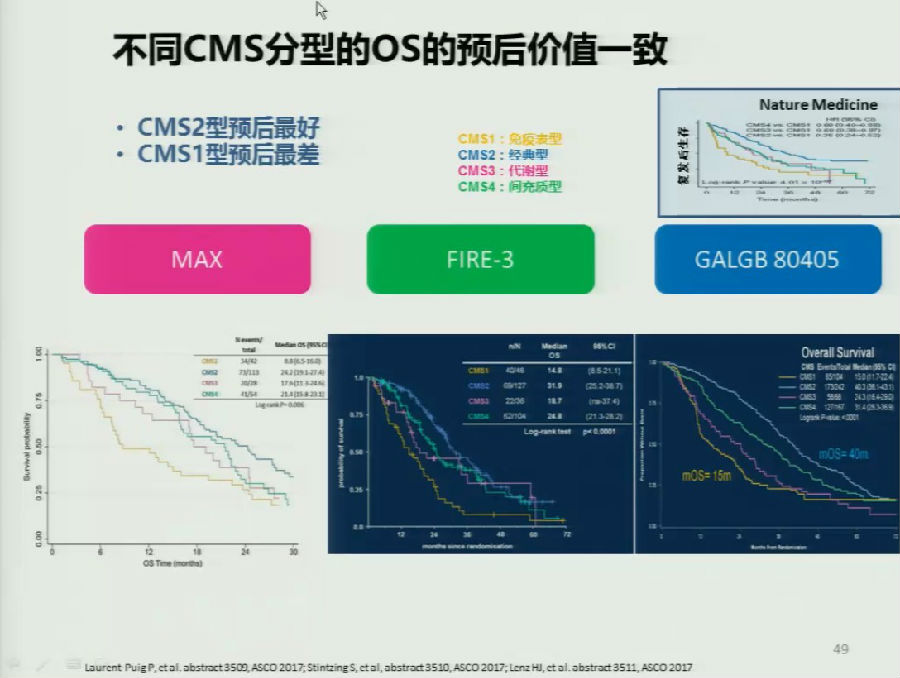
预后方面,几大研究总体来看也得到了类似的结果:CMS2型预后更好,CMS1型预后更差。而在FIRE-3和80405的研究数据对比可以发现,CMS分型也未能成功预测西妥昔单抗与贝伐珠单抗孰优孰劣。
总结
1.Ⅲ期肠癌患者的辅助治疗,低危患者可推荐3月,高危患者原则上应用6月辅助治疗;
2.一线RAS野生左半结肠癌化疗联合西妥昔,右半化疗联合贝伐,不排除联合西妥昔单抗的可能;
3.二线靶向治疗需要个体化考虑;
4.BRAF突变患者未来可能接受BRAF抑制剂+MEK抑制剂+EGFR单抗联合治疗。
5.免疫治疗对MSI-H患者有效已毋庸置疑,对于Lynch综合征患者也可以考虑应用,BRAF突变患者可以考虑应用ipilimumab+PD-1抑制剂。
6.CMS未来可能会发现它更多的价值,但目前来说对临床指导意义不大。





