
本文中,小编整理了2020年科学家们在基因编辑研究领域的重要研究进展,分享给大家!
【1】CRISPR两大“宗师”合作,揭示单碱基编辑器3D结构,解析脱靶机制
基因编辑领域两位“宗师”David Liu及Jennifer A. Doudna合作,首次揭开了一种“最有前途”的碱基编辑器的3D结构,为调整碱基编辑器,使之在应用过程中更加灵活和可控提供了一个参考。早期的腺嘌呤碱基编辑器(ABE)效率都很低。然而,最新的ABE8e却快到令人惊讶,对DNA的脱氨基速率比ABE7.10和miniABEmax分别高出590倍和1170倍。然而,这也意味着,ABE8e可能更容易造成脱靶效应。对此,研究人员利用冷冻电子显微镜(Cryo-EM)成像技术,解析了ABE8e结合DNA时的3D结构。活性检测表明, ABE8e之所以容易产生更多的脱靶编辑,是因为与Cas9融合的脱氨酶蛋白始终处于活跃状态。由于这项研究首次报告了这种融合蛋白的结构,它可能有助于指导无数其他基于Cas9的基因编辑工具的设计。该研究于7月31日发表在《科学》杂志上。

David R. Liu团队在哺乳动物细胞中38,538个基因组整合靶标上表征了11个胞嘧啶和腺嘌呤碱基编辑器(CBE和ABE)的序列-活性关系,并使用所得结果训练了BE-Hive机器学习模型,可准确预测碱基编辑基因型结果(R ≈0.9)和效率(R≈0.7)。研究人员以≥90%的准确度纠正了3388个与疾病相关的单核苷酸变异(SNV),其中包括675个等位基因,其“旁观者”核苷酸被BE-Hive正确预测,因此无法编辑。该研究发现了先前无法预测的C-to-G或C-to-A编辑的决定因素,并利用这些发现以≥90%的准确性纠正了174个病原性SNV编码序列。利用BE-Hive设计新的CBE变体,以调节编辑结果。这些发现启发了碱基编辑,实现了以前难以处理的目标的编辑,并为新的基础编辑器提供了改进的编辑功能。该研究于7月23日发表在《Cell》杂志。
DOI:https://doi.org/10.1016/j.cell.2020.05.037
【3】迄今最小基因编辑工具,体积仅为CRISPR-Cas9的一半!
加州大学伯克利分校创新基因组学研究所的研究人员发现了一种新型基因编辑工具——CasΦ,一种最小的CRISPR-Cas系统,由1〜70 KD的CasΦ蛋白和一个CRISPR阵列组成,且仅在巨大噬菌体的基因组中编码,其体积是CRISPR-Cas 9的一半。研究人员发现CasΦ在其天然环境中是一种功能性噬菌体蛋白和真正的CRISPR-Cas效应子,能够裂解crRNA互补的DNA。此外,这种单RNA系统比其他活性CRISPR-Cas系统紧凑得多。其中,具有单个指导RNA的CasΦ-2能够编辑多达33%的细胞,这与先前报道的CRISPR-Cas9,CRISPR-Cas12a和CRISPR-CasX的水平相当。这项研究于7月17日发表在《科学》杂志上。
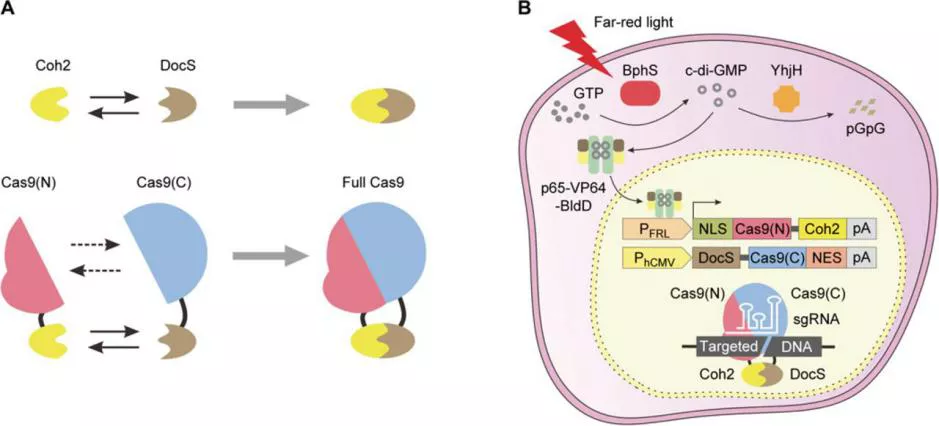
【4】叶海峰团队开发出远红光激活的基因编辑系统
华东师大叶海峰团队开发出了远红光(730 nm)激活的Split-Cas9(FAST)系统,该系统可无创地诱导动物组织内部深处的细胞中的基因编辑活性。FAST系统依赖于两个具有高亲和力结合域的分裂Cas9融合蛋白:Cas9的一半是组成性表达的,而另一半由该研究团队先前建立的细菌光敏色素BphS光学控制系统的FRL诱导控制。最初,研究人员在人类胚胎肾(HEK)-293细胞中放置了FAST系统组件,并使用基于发光二极管(LED)的远红光(FRL)照射来证明靶向基因组编辑的成功激活。之后,在不同的人类细胞系中实现了FRL诱导编辑后,研究人员通过植入物实验,证实FAST能够在位于动物皮下组织的细胞中强有力地激活基因编辑。然后,他们在转基因tdTOMATO报告小鼠系的实验中,建立了FRL诱导的小鼠体细胞(肝细胞)的快速介导编辑,以及在异种移植瘤小鼠中对癌细胞进行细胞周期失活基因编辑的研究,以此证明了FAST能够对抗疾病。这项研究于7月17日发表在《科学进展》杂志上。
DOI:10.1038/s41586-020-2477-4
【6】CRISPR编辑iPSC新进展:首次报告协同基因编辑效应
日本京都大学iPS细胞研究所的科学家最新研究表明(Nature Communications,2020),DNA DSB修复与细胞周期之间有协同作用,有利于ssOND介导的单核苷酸基因编辑。在iPS细胞中建立了基于GFP到BFP转化的荧光DNA修复测定方法,可视化定量单等位基因和双等位基因靶向过程中DNA修复结果的频率。研究发现,通过特定培养条件和小分子调节DNA修复和细胞周期,可协同增强同源性定向修复(HDR)的频率。但是,高频HDR编辑主要导致双等位基因报告基因系统中纯合突变体的产生,为了在这些条件下生产杂合突变体,这个团队采用了使用混合ssODN修复模板的策略,来保护具有沉默突变的一个等位基因。在内源性常染色体位点应用此协同基因编辑策略,与基线HDR水平相比,精确编辑生成的杂合和纯合突变提高了几倍。该研究于6月8日发表于《自然通讯》杂志。
DOI:10.1038/s41467-020-16643-5
【7】李大力团队开发新型双碱基基因编辑器
尽管碱基编辑器是用于精确基因组编辑的有用工具,但是当前的碱基编辑器只能转换腺嘌呤或胞嘧啶。华东师范大学李大力团队通过将两个脱氨基酶与一个Cas9切口酶融合来开发腺嘌呤和胞嘧啶双碱基编辑器(A&C-BEmax),以在同一目标位点实现C-to-T和A-to-G转换。与单碱基编辑器相比,A&C-BEmax对腺嘌呤的活性略有降低,而对胞嘧啶的活性较高,RNA脱靶活性大大降低。这项研究成果于6月1日发表在《自然生物技术》杂志。
DOI:10.1038/s41587-020-0527-y
【8】摆脱PAM限制,基因编辑工具再升级
哈佛医学院和麻省总医院的Benjamin P. Kleinstiver实验室再度对SpCas9蛋白进行了强势升级,改造后的SpCas9突变体SpRY几乎完全摆脱了PAM困扰,其识别的PAM序列涵盖NRN和NYN(Y为C/T)(NRN > NYN)。SpRY和以此为基础构建的单碱基编辑系统在PAM为NRN的位点处展现出强大的编辑能力,而在PAM为NYN的位点处的编辑能力虽然有所降低,但依然可观。该研究开发的SpCas9突变体SpRY是当前对PAM序列兼容性最高的SpCas9突变体,几乎完全摆脱了PAM序列的限制,其在基因组范围内的编辑能力得到了极大的提高,而衍生而来的单碱基编辑系统让精准编辑几乎拓展至全基因组范围。这项研究成果于3月27日发表在《科学》杂志上。
DOI: 10.1126/science.aba8853
针对基因编辑领域的研究不胜枚举,以上仅罗列了其中的一小部分。在基因编辑技术取得一个又一个突破后,又因其技术上的潜在风险而饱受争议。未来基因编辑技术又该何去何从?我们能否合理的利用这把“上帝赐予的手术刀”?这是一个值得思考的问题。但在未来,科学家将对基因编辑的机制进行深入的剖析,相信有朝一日,科学家能够利用基因编辑技术克服疾病,造福人类健康。(转化医学网360zhyx.com)



