文章来源:中华检验医学杂志, 2023,46(4) : 347-359
作者:中国中西医结合学会检验医学专业委员会
摘要
胃癌是我国发病率第一的消化道恶性肿瘤,根据《2020全球最新癌症负担数据》显示,2020年我国胃癌新发478 508万例,发病率约33.06/10万,居中国恶性肿瘤发病率第2位;死亡373 789万例,死亡率约25.82/10万,位列我国恶性肿瘤死亡率第3位[1]。幽门螺杆菌(Helicobacter pylori,Hp)感染和胃癌筛查不足是我国胃癌高发的关键因素。我国目前Hp感染率达50%~56%,约7亿人被感染[2]。在过去60年,西欧和北美的胃癌发病率逐渐下降,部分原因归功于分餐制控制了Hp传播,降低了胃癌发生风险[3, 4]。除胃癌风险因素减少和生活习惯改善等因素[2,5],对胃癌高危人群进行胃癌筛查已成为有效方法之一[6, 7, 8, 9]。据数据统计显示,胃癌患者的中位总生存时间仅16个月[10],为了延长患者5年生存率,早期发现早期治疗无疑是解决问题的关键。因此,提升我国早期胃癌检验技术水平,提高早期胃癌筛查覆盖率是降低我国胃癌死亡率和提升早期胃癌检出率的重要措施[11, 12]。
早期胃癌预后良好,5年总生存率达90%以上[13, 14],进展期胃癌5年生存率仅为30%[15, 16]。而我国早期胃癌诊断率低于10%,这是胃癌发病率和死亡率居于前列的重要原因[17]。《“健康中国2030”规划纲要》明确提出有序扩大癌症筛查范围,推进癌症早发现、早诊断、早治疗,降低癌症发病率和死亡率,总体癌症5年生存率提高15%[18]。《癌症防治实施方案(2019—2022年)》要求医院建立“癌症筛查和早诊早治中心”,开展胃癌机会性筛查[19]。机会性筛查可有效提高胃癌高危人群的早期诊断率,扩大癌症筛查覆盖率,防止早期胃癌进展为中晚期胃癌。因此,我国亟待建立有效的标志物体系和用于大规模人群筛查的检测方法以预警胃癌的发生[20]。
早期胃癌的检出是我国面临的一个重大挑战。在胃癌发生早期,患者往往无明显症状和体征,因此大部分确诊时已进展至中晚期,且常伴有远处转移[21]。晚期患者通常具有吞咽困难、虚弱、消化不良、呕吐、体重减轻、早期饱腹感和/或缺铁性贫血等症状,这些非特异性症状容易被忽略,严重耽误了病情控制和治疗的最佳时间[4]。胃镜和活检是目前诊断胃癌的金标准[22, 23],是临床上常用的胃肠道黏膜病变诊断方式。但中国胃癌危险人群超过3亿人,现有的医疗资源只能完成每年3 000万例的胃镜检查[24]。同时患者对侵入性检查依从性低,因此胃镜与活检难以应用于大规模胃癌筛查。尿素呼气检测[25, 26]、基因甲基化检测[27]、胃蛋白酶原(pepsinogen,PG)检测[28]、胃泌素17(gastrin-17,G-17)检测[11]等属于无创检验,将可能筛选患有胃部疾病的人群,从而进行精准预防[29]。以早期胃癌检验技术作为出发点的共识或指南可进一步提升我国早期胃癌筛查水平,因此,中国中西医结合学会检验医学专业委员会组织国内相关领域专家进行讨论并制定本共识,以期更好地应用于临床。
一、胃癌高危因素
胃癌的发展是一个慢性、多因素参与的恶性上皮黏膜病变[11,30, 31, 32],病理学上胃癌的连续发展过程为慢性萎缩性胃炎、肠上皮化生或异型增生、原位癌、浸润性胃癌[33],其中胃癌常见的癌前病变是指异型增生(上皮内瘤变)的病理学概念,位于胃癌发展过程中的肠上皮化生阶段。上皮内瘤变分为低级别和高级别;低级别需要临床随访,定期监测;高级别则建议进行内镜检查和胃黏膜切除。癌前病变可进一步发展为早期胃癌,根据美国癌症联合会发布的胃癌TNM分期标准(第7版)[34],早期胃癌(T1N0/1~3)包括黏膜内浸润癌和黏膜下浸润癌,无论有无区域淋巴结转移。从癌前病变到早期癌症直至进展期胃癌的时间窗为胃癌的早期预防和诊断提供了有利时机。
胃癌的发病率和死亡率均随年龄增长而上升,在《中国早期胃癌筛查流程专家共识意见》[20]中,我国学者建议将40岁作为胃癌筛查的起始年龄。此外,早期胃癌无明显症状,因此不应因无症状而忽视胃癌高危人群。该共识指出,胃癌高危人群一般指年龄40岁及以上,且有胃癌高发区、Hp感染、既往胃癌前疾病、胃癌患者一级亲属、存在胃癌其他高危因素的人群。此外,该共识以由5 000多例验证队列证实的新型胃癌筛查评分系统为依据,建议对有吸烟史、有重度饮酒习惯、作息和饮食不规律、近亲有胃癌患者的人群每年进行1次胃部检测,并建议对Hp感染者和既往患有慢性萎缩性胃炎、慢性胃溃疡、胃息肉、胃黏膜肥厚等其他胃癌前疾病的人群,每3~6个月进行1次胃部检测。
二、早期胃癌的检验技术
《中国早期胃癌筛查流程专家共识意见》[20]总结了胃癌筛查方法和策略,明确了胃癌筛查推荐流程,采用新的胃癌风险人群筛查评分系统,提出内镜精查策略,以提高早期胃癌诊断率。早期胃癌检验技术根据检验样品及检测方式不同可以分为呼气检测技术、血清学免疫检测技术和分子检测技术。
(一)呼气检测技术
呼气检测即通过检测呼出的气体进行疾病诊断。呼气检测技术分为两类:一类是检测呼气中的无机物。临床中已有的呼气检测项目包括Hp检测、一氧化碳检测新生儿黄疸、一氧化氮检测哮喘等,其中应用最广泛的是尿素呼气试验(urea breath test,UBT)检测Hp[35],受检者通过口服带有示踪标记的尿素丸,Hp产生的尿素酶会分解尿素,通过测定其呼出气体中同位素标记的二氧化碳判断有无Hp感染,灵敏度可达90%以上[35],该呼气检测技术可进一步评估早期胃癌发生的风险因素。在实际应用中,上呼吸道感染患者可能会服用抗生素或消炎类药物,易导致UBT结果呈假阴性[2]。因此,建议上呼吸道感染患者在愈后再进行呼气检测。另一类是检测呼气中的有机物,这类标志物反映人体生理病理信息,可作为疾病诊断和健康监测的依据。2017年,呼气挥发性有机物检测[36]实现了一次性诊断胃癌、肺癌、结直肠癌等17种高发癌症。呼气检测技术具有操作简易、精准、无创的优势,无机物呼气检测成本低、实现设备小型化,适用于大范围临床应用。有机物呼吸检测现阶段离不开高精密度的色谱和质谱分析技术,暂不适于大规模临床应用。
共识1 呼气检测技术主要检测Hp感染,可用于早期胃癌风险评估和胃部健康监测。
(二)血清学免疫检测技术
血清学免疫检测技术是以血液为样本,在体外进行的抗原抗体反应,在胃癌早期检验中,具有非侵入性、依从性好、操作方便等优势。应用比较广泛的是化学发光免疫分析(chemiluminescent immunoassay,CLIA)和酶联免疫法(enzyme linked immunosorbent assay,ELISA)。
1.CLIA:CLIA是将发光物质或酶标记在抗原或抗体上,利用抗原抗体特异性反应将待测抗原从复杂样品(血清等)中分离出来,免疫反应结束后,加入氧化剂或酶底物而发光,通过测量发光强度,根据标准曲线对待测物的浓度进行定量分析。CLIA技术具有快速、准确、灵敏、安全无污染、自动化程度高等特点,并广泛应用于肿瘤、传染病、心脏疾病等临床检测。CLIA可检测多种类别的免疫检测标志物,包括肿瘤标志物的检测。已广泛应用于临床的胃癌标志物包括癌胚抗原(carcino-embryonic antigen,CEA)、糖类抗原(carbohydrate antigen,CA)19-9、CA72-4和CA24-2等[37]。
2.ELISA:ELISA用于检测血清中肿瘤标志物的蛋白表达水平,可实时检测表达、用于术后监测。临床ELISA测定通常为采用手工操作的以微孔板条为固相的测定模式。操作过程简单,涉及标本的收集保存、试剂准备、加样、温育、洗板、显色、比色等过程。ELISA测定的临床标本包括血清(浆)、唾液、脑脊液、尿液、粪便等标本。使用血清标本测定的标志物有传染性病原体的抗原和抗体、肿瘤标志物、激素和特种蛋白等。ELISA具有灵敏度高、特异性强、无痛苦、检测成本低、方便快捷等特点。在临床研究中,ELISA可用于人体血清PG水平或胃特异性蛋白三叶因子1(refoil factor family,TFF1)和去整合素金属蛋白酶12(a disintegrin and metalloproteinase,ADAM12)等含量的检测[38],但其作为传统检测手段,在实际应用中其灵敏度和自动化程度不及化学发光技术,已逐步被取代。
3.其他免疫检测技术:免疫检测技术中还有一些其他常用技术,例如胶体金免疫层析法(gold immunochromatography assay,GICA)和荧光免疫层析法(fluorescence immunochromatography assay,FICA)。GICA是以硝酸纤维素膜为固相载体,胶体金为标记物,通过抗原抗体特异性反应建立的一种新型诊断技术,具有方便、快捷、廉价、易保存等优势,目前已应用在胃癌检测中,例如Hp抗原抗体检测等[39]。胶体金免疫层析试纸条具有成本低廉、样品需求量低、便携、灵敏度高等优势,但只能实现定性或半定量检测。FICA是在免疫层析技术的基础上,通过检测荧光信号强度来定量检测待测物浓度的技术。FICA具有灵敏度高、稳定性强和成本低等特点,在早期胃癌中应用于CEA和G-17等标志物的检测[40],其局限性与免疫层析标记原料的选择密切相关。
共识2 血清学免疫检测技术可用于多种血清肿瘤标志物及胃特异性蛋白的检测,以辅助早期胃癌的筛查。
(三)分子检测技术
分子检测技术是应用分子生物学方法分析受检者基因是否有缺陷或者表达产物是否异常,以此达到疾病诊断的目的。目前应用于胃癌早期诊断的分子检测技术有荧光定量PCR检测、二代测序(next-generation sequencing,NGS)以及质谱检测技术。
1.荧光定量PCR检测技术:荧光定量PCR检测技术是指在PCR反应体系中加入荧光基因,利用荧光信号累积实时监测整个PCR进程,最后通过标准曲线对未知模板进行定量分析的方法。该技术利用荧光定量PCR仪,操作简单,同时具有高灵敏度和特异度、自动化程度高、无污染和实时等特点,检测的样本包括胃活检组织、粪便、血液、牙菌斑、唾液等。实时荧光定量PCR检测技术不但能有效地检测到肿瘤早期的基因突变,而且可以准确检测这一阶段基因表达量。目前胃癌检测的标志物包括SLC6A3、Septin9、RNF180等[27,41]。利用PCR荧光探针法,将甲基化的DNA做三重PCR扩增,与甲基化RNF180基因和Septin9基因序列特异性结合的荧光素探针可以在PCR反应中专一地检测出甲基化序列,以此实现胃癌基因甲基化检测。除此之外,荧光定量PCR检测技术目前已应用于多种微生物感染的检测,包括Hp分型检测及耐药性检测[42],在分子水平上实现快速检测CagA和VacA基因,并鉴定由23S rRNA基因突变介导的克拉霉素耐药性[43]。
2. NGS检测技术:NGS作为一种高通量基因测序手段,主要技术方案包括靶向测序、全基因组测序、全外显子测序等[44]。在肿瘤研究领域,NGS用于伴随诊断、鉴别诊断、肿瘤早筛和微小残留病灶(minimal residual disease,MRD)复发监测等。一项循环游离基因组谱临床试验[45]表明,甲基化检测比碱基突变和基因片段拷贝数变异能更准确地用于筛选。该研究研究了近3 000万个甲基化位点,筛选出泛癌靶向甲基化检测位点,并对2 823例癌症患者和1 254名健康人进行靶向甲基化检测。结果显示泛癌早筛可检测胃癌、结直肠癌、食管癌、肝癌、肺癌等50多种癌症,Ⅰ~Ⅲ期癌症诊断的灵敏度约40.74%;对单种癌症,如Ⅰ~Ⅲ期胃癌诊断的灵敏度约为67.6%,在检测结果为阳性的样本中提供了原发肿瘤的高精度定位预测[45]。NGS的优势体现在高速测序和样品的大规模处理,但其成本较高,对数据处理专业能力要求高。
3.质谱检测技术:生物质谱技术是蛋白质组学中的核心技术[46]。目前最常用的基质辅助激光解吸电离飞行时间质谱[47]可用于肿瘤早期诊断、疗效监测和预后评估等。有研究发现利用质谱技术可筛选血清脂质标志物,比如脂肪酸合成酶和硬脂酰辅酶A1等[48],且早期胃癌组织的脂肪酸上调与脂肪酸合成酶过表达有关。质谱检测技术具有快速、准确、灵敏、自动化及高通量等优势,广泛应用于微生物领域,例如Hp表达蛋白的分析筛选。此外,质谱支持的蛋白质组学有助于发现肿瘤生物标志物,Zhou等[49]采用质谱检测技术分析了早期胃癌组和对照组的血液样本,共鉴定出2 040种蛋白质,发现了11种差异表达的蛋白。该技术有助于早期胃癌的鉴别,并为早期胃癌的诊断提供潜在的生物标志物。
共识3 荧光定量PCR检测技术适于现阶段早期胃癌检验技术的发展需求;NGS目前更多应用于前瞻性临床试验;质谱检测技术可用于早期胃癌差异蛋白的筛选。
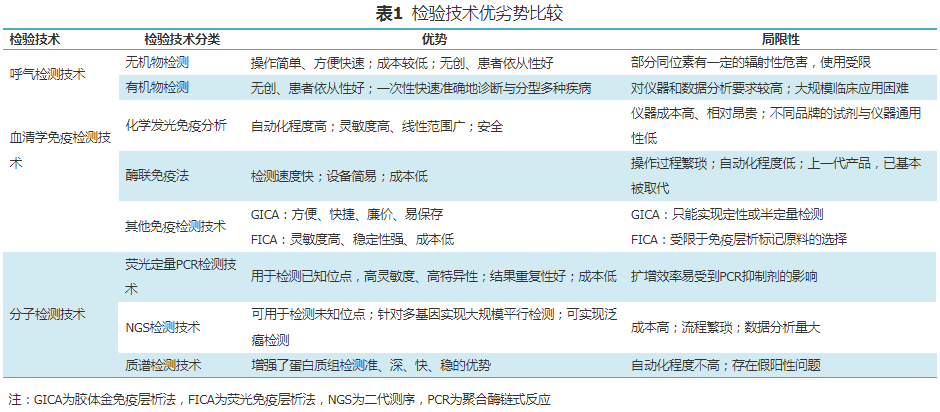
(四)检验技术优劣势比较
本共识详细分析了早期胃癌的检验技术方法,侧重于预防和早检。各种常见的早期胃癌检验技术各有优势和局限性(表1)。
三、早期胃癌检验标志物
早期胃癌检验技术促进了相关标志物的发现与应用性发展,分为Hp标志物、PG和胃泌素等胃相关标志物、肿瘤标志物和基因甲基化标志物。
(一)Hp标志物
Hp是一种螺旋形革兰阴性细菌,定植于胃黏膜的黏膜坑层[50]。Hp慢性感染引起的慢性胃炎是持续性炎症的早期表现,随着病情的发展,胃上皮细胞的损伤可导致胃癌的发展[30,51, 52]。20%的感染患者会在胃基质中出现胃溃疡或增生性息肉。感染还会导致胃组织内上皮-间质转化的进展,增加胃癌发展的可能性[53]。虽然世界上有一半人口感染Hp,但仅1%~2%的感染者发展为胃癌。在亚洲进行的一项前瞻性研究中,3%~6%Hp感染受试者在10年内发展为胃癌[54]。2021年美国卫生及公共服务部下属美国毒理研究所发布了第15版致癌物报告,Hp慢性感染被列为明确致癌物且Hp阳性感染者患胃癌的风险比例比阴性者高4~6倍。因此,定期进行Hp检测有助于预防早期胃癌[55]。2020年召开的亚太消化系医学会会议上,来自11个国家的28名专家建议,Hp感染的筛查和治疗策略最好在萎缩性胃炎和肠化生发生前进行,晚期胃萎缩或肠化生患者应在根除Hp后接受内镜监测[56]。临床测定Hp的方法包括UBT、抗体检测、粪便抗原检测、快速尿素酶检测等,由于患者依从性高和操作简便等优势,UBT和血清Hp抗体检测是常用的2种检测方式。
1.UBT:UBT包括C13-UBT和C14-UBT,可作为一种与组织学及/或细菌培养相仿的诊断Hp感染的金标准。Best等[35]纳入101项研究,涉及11 003名受试者,比较了UBT、血清学和粪便抗原检测等方式在有症状和无症状人群中Hp感染的诊断准确性,其中C13-UBT对Hp感染诊断的灵敏度为0.94(95%CI 0.89~0.97),C14-UBT对Hp感染诊断的灵敏度为0.92(95%CI 0.89~0.94)。UBT对Hp感染诊断的灵敏度和特异度较高,操作简便,具有明显优势。需要注意的是,由于C13检测比C14辐射量小,C13检测更适用于儿童和孕妇群体。
2.血清Hp抗体检测:Hp感染的血清学反应可以通过测定抗Hp免疫球蛋白G(IgG)抗体来评估[57]。Hp根除后抗体仍能持续存在半年以上,因此血清Hp抗体检测不适用于疗效监测。一项包括2 560例受试者的回顾性研究显示,血清Hp IgG的灵敏度高于UBT和粪便抗原试验[58],其灵敏度和阴性预测值使其可应用于胃癌高危人群的分层。对于血清学检查已经呈阳性的人群,进一步进行粪便抗原或UBT检测,可有效提高患病人群的诊断准确性[35,58]。
Hp感染发展为胃癌与Hp携带的毒力因子及毒力多样性有关。表达空泡毒素蛋白(vacuolating cytotoxin A,VacA)和细胞毒素相关基因A(cytotoxin-associated gene A,CagA)是公认的Hp致病因子[59, 60],临床上将Hp分为Ⅰ型和Ⅱ型,Ⅰ型Hp具有侵袭性,其VacA和CagA抗体呈阳性,促进胃溃疡、胃癌的发生发展。而Ⅱ型Hp的VacA和CagA抗体为阴性,不产生细胞毒素菌株,毒性较小。对于消化道Hp感染者,分型检测为根治性治疗提供了重要的诊断价值[61]。
共识4 Hp感染是胃癌防治中可控的危险因素,可通过UBT和血清Hp抗体检测来评估胃癌高危人群。UBT中的C13检测辐射量小,更适用于儿童和孕妇群体。血清Hp抗体在Hp根除后仍能持续存在半年以上,不适用于疗效监测。
(二)胃相关标志物
血清PG原和血清胃泌素反映胃黏膜不同部位的健康状态,两者的含量变化对胃部疾病的诊断具有临床价值。
1.血清PG原检测:PG是胃蛋白酶促酶,其血清水平反映不同部位胃黏膜的形态与功能,在血液中作为胃黏膜改变的间接性标志物。PG根据生化性质及免疫原性分为PG-I与PG-Ⅱ[28,62],PG-I主要由胃底与胃体(近腹端)的主细胞分泌产生,是评价胃泌酸腺细胞功能的指标;PG-Ⅱ由胃底腺主细胞及黏液颈细胞分泌,与胃底黏膜病变相关性较高。在Hp感染患者中,血清PG-Ⅰ或PG-Ⅰ/PG-Ⅱ的比值(PGR)与胃癌患者同样表达降低,易导致假阳性的产生,因此PG检测通常不被用作大规模的胃癌筛查。但是研究表明,PG检测对于根除Hp后的胃癌癌前病变筛查有效。PG检测体系测定抗体-抗原复合物浓度的方法不同[63, 64],阳性样本的测定数值和阈值显著不同,导致结果的不确定性[62,65]。在实际操作中,通常使用PG-Ⅰ<70 ng/ml且PGR<3作为诊断萎缩性胃炎的临界值[66],当PG-Ⅰ与PGR同时满足临界值时,才判断为阳性。由于PG检测受不同地区饮食习惯的影响较大,因此推荐不同地区根据当地的实际情况建立适合本实验室的参考区间。血清PG水平异常是胃癌发生的风险因素,Zhang等[67]在对1 501名高发胃癌社区人群测定血清PG水平后,进行了14年的胃癌发展跟踪调查,结果显示PG水平异常人群的胃癌发病率高于PG正常人群胃癌的发病率(23.1‰比5.93‰,P<0.05)。《中国胃癌筛查与早诊早治指南》[68]明确指出血清PG检测主要反映萎缩性胃炎,联合Hp可以用于胃癌高危个体的检测。但由于PG诊断早期胃癌的灵敏度较低,不建议将PG检测单独用于胃癌筛查。
2.血清胃泌素检测:胃泌素由胃窦G细胞在正常生理消化过程中释放,G-17是外周血中最丰富的循环胃泌素[11,69]。有胃部疾病的患者的胃黏膜功能与健康人群具有明显的区别,血液中G-17水平偏高。Zagari等[70]对包含4 241例受试者的20项研究的荟萃分析评估了血清标志物对预测胃部疾病的检验效果,结果显示G-17对萎缩性胃炎诊断的灵敏度为62%(95%CI 0.49~0.74),特异度为91%(95%CI 0.81~0.96)。近年来,PG和G-17联合检测被称为新“ABC”法,2018年李梦颖等[71]研究了新“ABC”法对胃癌诊断的灵敏度和特异度分别是92.59%和54.46%,对癌前病变诊断的灵敏度和特异度分别为62.10%和75.00%,与旧“ABC”法(PG联合Hp IgG抗体检测)相比,新“ABC”法对胃癌诊断的灵敏度和特异度更高。这些研究表明单一血清学标志物的诊断效果有限,不同标志物的组合可提高诊断价值[72]。仅通过血清学检测排除胃黏膜病变在临床上容易引起误诊,因此有必要综合利用各种临床数据,以便获得最佳诊断。
共识5 PG主要检测萎缩性胃炎,G-17检测覆盖胃溃疡、慢性萎缩性胃炎、胃癌等多种胃肠道疾病。Hp感染患者的血清PG-I或PGR呈降低表达,建议根除Hp后,再做胃癌癌前病变的PG筛查。PG和G-17联合检测对胃部疾病诊断价值高,可用于胃癌风险提示。
(三)肿瘤标志物
肿瘤标志物是肿瘤本身或宿主微环境中存在或产生的物质,涵盖蛋白质、激素、酶等代谢物,能够响应肿瘤的发生和发展,并且可以通过化学、免疫学和分子生物学技术进行定性或定量检测[73]。传统消化道肿瘤标志物包括CEA、CA19-9、CA72-4等[74, 75, 76]。
1.CEA:CEA是一种参与细胞黏附的糖蛋白,在健康个体的血液中水平较低[77],当内胚层分化组织出现病变时,血液中CEA水平会明显升高[78, 79]。Deng等[80]检索了14 651例胃癌患者数据,通过荟萃分析寻找CEA水平变化与胃癌预后的相关性,结果表明CEA水平升高与胃癌预后不良风险呈正相关,CEA可能作为影响胃癌预后的独立因素。同时也有研究表明CEA在早期胃癌诊断中不具有明显价值。So等[81]对4 566例受试者进行了上消化道内窥镜检查,并测定了CEA、CA19-9、PG等基于血液的胃癌标志物的检测性能,结果显示CEA对早期胃癌诊断的特异度虽然高于90%,但灵敏度低于30%,表明CEA单独检测在早期胃癌诊断中价值有限[80, 81, 82, 83]。
2.CA19-9:CA19-9是一种存在于血液循环中的非特异性肿瘤糖类抗原,在黏液性肿瘤中会异常升高[84, 85],主要用于鉴别诊断胃癌、胰腺癌以及结直肠癌等[86, 87, 88]。Wang等[89]对一项由329名参与者组成的队列进行了G-17、CEA、CA19-9和CA12-5 4项指标在胃癌检测灵敏度方面的对比显示,CA19-9对胃癌诊断的灵敏度(20.00%)较低,这阻碍了其在早期胃癌诊断中的进一步应用。而CA19-9与其他血清标志物的联合检测在胃癌诊断中具有明确的诊断价值,Liang等[90]对4 157名受试者(包括2 288例胃癌患者和1 869名健康人)联合检测了CA19-9、CA72-4和CEA,其对于胃癌诊断的灵敏度由单独CA19-9的21.4%上升至48.2%,有效降低了胃癌漏诊率。
3.CA72-4:CA72-4是一种高分子糖蛋白抗原,在良性肿瘤组织、体液和正常组织中不表达,但是在胃肠道肿瘤中高水平表达,并且可以释放到血液中用于胃癌检测。CA72-4通常被用作检测胃癌和其他消化系统肿瘤的指标[91],为非特异性肿瘤标志物。Guo等[83]对522例胃癌患者,85例癌前病变患者以及219名健康人群进行了CEA、CA72-4和CA19-9的诊断性能评估,结果显示,CA72-4诊断胃癌的综合灵敏度为63.24%,特异度为61.46%,但是无法有效区分健康人群和早期胃癌患者。Shimada等[92]评估了肿瘤标志物在胃癌诊断中的临床价值,结果显示CA72-4诊断Ⅰ期胃癌的灵敏度为12.0%,Ⅱ期的灵敏度为15.6%。虽然临床上不建议单独使用CA72-4诊断早期胃癌,但其在晚期胃癌诊断中具有明显优势。Ohashi等[93]利用CEA和CA19-9肿瘤标志物的动态变化监测胃癌术后患者是否复发,综合分析显示,肿瘤标志物动态变化对预后评估的效用较为明显。
共识6 CEA、CA19-9、CA72-4等作为胃癌辅助诊断肿瘤标志物,对早期胃癌的诊断价值有限。监测上述肿瘤标志物的动态变化有助于胃癌预后评估,且CEA、CA19-9、CA72-4联合检测可降低胃癌漏诊率。
(四)基因甲基化标志物
早期胃癌检验现有标志物的发展与局限性在一定程度上促进了新标志物的产生。如何最大程度地解决临床面临的问题,不仅需要提升现有技术,更需要推进新技术。特定基因甲基化异常对于癌症的早期诊断非常有益[94, 95],例如用于胃癌早期检测的RNF180/Septin9基因甲基化等。
1.RNF180/Septin9(RS19)基因甲基化:研究发现,在胃癌患者血浆样本中甲基化的RNF180及Septin9含量特征性增高[96]。RNF180作为肿瘤抑制基因,可抑制胃癌细胞的生长增殖和迁移[97, 98]。当RNF180启动子区域发生甲基化时,间接促进胃癌细胞的生长、分化及转移[99]。2012年Cheung等[100]在56%的胃癌患者血浆中检测到RNF180基因处于高甲基化状态,在健康对照组中未检测到。Septin9基因同属抑癌基因,与细胞凋亡及细胞分裂有关。Song等[101]对2 030例受试者进行Septin9基因甲基化检测,结果表明Septin9基因甲基化诊断胃癌灵敏度为47.7%,特异度为92.3%,但单一指标Septin9基因甲基化不足以反映胃部病变情况。
RS19基因甲基化检测是联合RNF180和Septin9两个基因,利用PCR荧光探针法,通过DNA提取、亚硫酸氢盐转化和多重RCR等步骤完成外周血中游离DNA的甲基化检测。由空军军医大学第一附属医院主导的RS19对于早期胃癌诊断性能的临床试验共入组1 382例患者,其中胃癌患者680例,非胃癌患者702例。以胃镜和/或病理结果检测为参照,RS19基因甲基化检测对胃癌的诊断灵敏度为61.76%,其中Ⅰ期的灵敏度为50.00%,Ⅱ期的灵敏度为62.32%。Cao等[102]在一项用Septin9和RNF180联合诊断早期胃癌的研究中证明该检测的诊断灵敏度远高于传统肿瘤标志物,且假阳性率低于15%,有助于早期胃癌的及时发现。
2.多基因甲基化联合其他指标检测:多基因联合甲基化检测可提高早期胃癌检测性能[103]。Ren等[104]鉴定了153种DNA甲基化生物标志物(包括DOCK10,CABIN1和KCNQ5等),对Ⅰ、Ⅱ、Ⅲ/Ⅳ期胃癌诊断的灵敏度分别为44%、59%、78%,特异度为92%。基因甲基化和其他标志物联合检测也能有效提高检测性能。当Septin9基因甲基化与CEA、CA724、γ-突触核蛋白或甲胎蛋白联合使用时,对胃癌诊断的灵敏度提高21%[101]。Yang等[96]纳入了518例受试者进行前瞻性队列研究,结果显示RS19联合CA72-4对胃癌诊断的灵敏度比单基因甲基化检测提高31.5%,因此RS19联合其他指标检测可提高早期胃癌检出率。
共识7 RS19基因甲基化可用于检测早期胃癌,阳性受检者应及时进行胃镜检查;RS19基因甲基化联合肿瘤标志物可进一步提升胃癌诊断灵敏度。
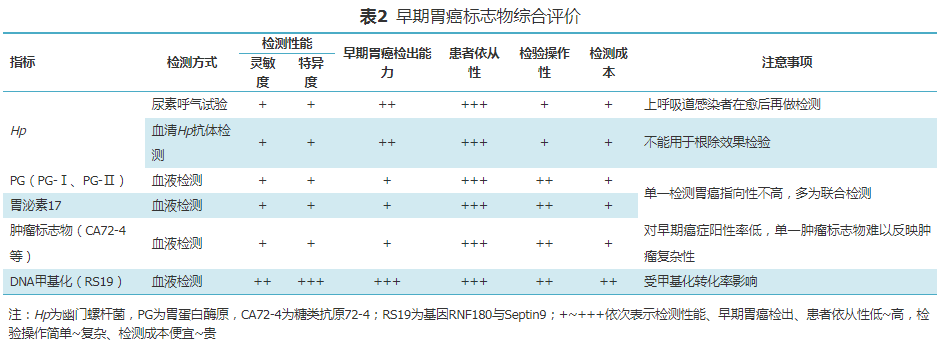
(五)早期胃癌标志物综合评价
对利用这些技术进行早期胃癌检测的标志物进行综合评价,包括检测性能(灵敏度、特异度)、早期胃癌检出能力、患者依从性、操作简便性、检测成本等(表2),供临床诊断选择参考。
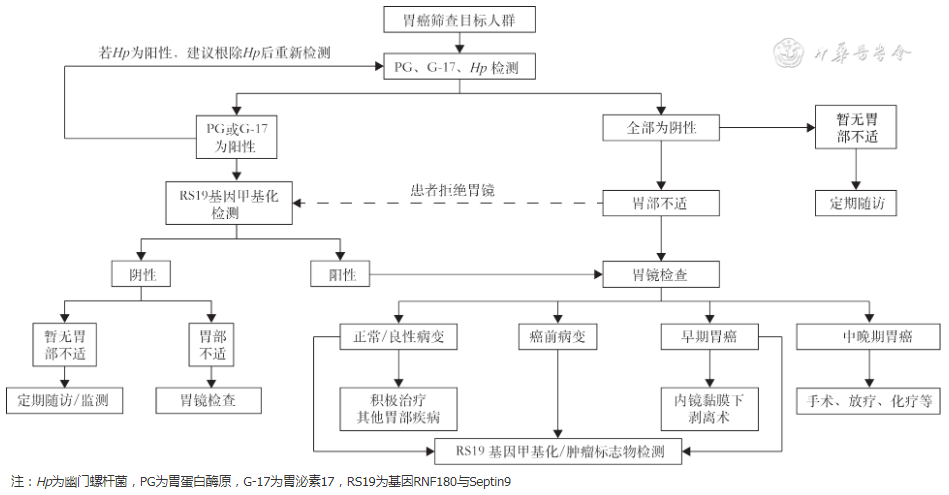
四、早期胃癌检验推荐流程
为进一步规范早期胃癌检验流程,在此结合各个技术以及标志物检测的特点和适用场景,从早期胃癌检验技术角度出发作出检验推荐流程(图1)。其中胃癌筛查目标人群是指40岁以上且有Hp感染风险、有既往胃部疾病、有胃癌家族遗传史等风险因素的人群。
图1 早期胃癌检验推荐流程
针对胃癌筛查目标人群,参考《中国早期胃癌筛查及内镜诊治共识意见》[105]对胃癌高危人群的划分标准。对胃癌高危人群进行PG、G-17和Hp检测,当任意一项检测结果为阳性时,建议进行RS19基因甲基化检测,并及时关注胃部健康。当基因甲基化检测也呈现阳性时,应及时进行胃镜检查,排除癌症风险,对于印戒细胞癌还需CT等影像学检查;如果临床确诊为癌前病变,进行相关治疗的同时,建议后续继续关注胃部健康,利用RS19基因甲基化或者肿瘤标志物进行随访监测;如临床确诊为胃癌,在术后或者放化疗治疗后,应注意定期随访,预防复发。如果上述指标检测结果为阴性,但是患者已出现胃部不适,建议结合临床表现进行胃部检查。
共识8 PG、G-17、Hp检测可作为胃癌筛查目标人群的初筛项目,RS19基因甲基化检测作为胃癌高危筛查辅助诊断,胃部不适或RS19基因甲基化检测阳性的患者建议胃镜检查和活检。
综上,本共识探讨了呼气检测、血清免疫学、分子检测等早期胃癌检验技术。呼气检测技术中应用最为成熟的是UBT检测Hp。血清免疫学检测中的CLIA技术在临床应用中优于ELISA,在肿瘤标志物检测中具有较好的应用前景,由于仪器成本高,适用于大型三甲医院或检测机构;而ELISA技术更适于基层医疗机构。分子检测技术包括荧光定量PCR、NGS和质谱检测等,NGS侧重于DNA检测,但仍处于发展阶段,如何降低筛查成本、解读海量数据等是亟待解决的问题。荧光定量PCR检测技术不仅可检测DNA,也可应用于基因甲基化检测,以辅助诊断早期胃癌。由于PCR仪器的大量出现和广泛使用,也使荧光定量PCR技术普遍适用于所有检测实验室;质谱可通过蛋白筛选来达到发现早期胃癌的目的,在揭示癌症发生的分子机制中将持续发挥作用。
检验技术的发展推动着早期胃癌标志物的发现、发展与利用。Hp感染是胃癌发生的危险因素,建议将Hp感染检测作为早期胃癌筛查的必检项目之一。PG检测对根除Hp后的胃癌癌前病变筛查有效,临床中PGR联合检测具有明确的诊断价值。同时PG和G-17联合检测较单一指标检测具有更好的胃癌诊断价值。肿瘤标志物CEA、CA19-9、CA72-4检测对于早期胃癌诊断的灵敏度不高,但在中晚期胃癌中表现良好,并且与其他标志物联合使用在一定程度上会提高胃癌诊断的灵敏度;RS19基因甲基化适用于胃癌高风险人群的检测,可用于早期胃癌机会性筛查,同时RS19基因甲基化联合肿瘤标志物检测可提高对早期胃癌的诊断效能。需要注意的是,上述标志物检测结果即使为阴性时,也不能作为是否做胃镜筛查的决定性因素,必须结合临床症状进行综合判断。
在防癌抗癌方案中,通过早期筛查,可有效提高治愈率、降低死亡率。因此,本共识结合早期胃癌检验技术的发展情况和实际临床应用特点,提出合理化建议,达成共识。在临床实际应用时,对于以上早期胃癌检验技术和标志物,在选择过程中应充分考虑受检者的依从性、实际健康状况、医疗成本支出等因素,选择其中一种或多种检验方法,以惠及更多患者。目前临床早期胃癌的确诊率仍远远不够,因此提升检验技术,优化标志物势在必行。
执笔人:马亮(中日友好医院检验科),曹永彤(中日友好医院检验科)
专家组成员(按姓氏汉语拼音排序):曹颖平(福建医科大学附属协和医院检验科),曹永彤(中日友好医院检验科),陈鸣(陆军军医大学西南医院检验科),崔丽艳(北京大学第三医院检验科),丁海涛(内蒙古自治区人民医院检验科),段勇(昆明医科大学第一附属医院检验科),关明(复旦大学附属华山医院检验科),郭玮(复旦大学附属中山医院检验科),黄涛(海南省人民医院检验科),黄宪章(广东省中医院检验科),贾玫(北京大学人民医院检验科),李传保(北京医院检验科),李冬(上海市同济医院检验科),李国新(南方医科大学南方医院),李海霞(北京大学第一医院检验科),李敏(上海交通大学医学院附属仁济医院检验科),李一荣(武汉大学中南医院检验科),李永哲(北京协和医院检验科),林发全(广西医科大学第一附属医院检验科),刘向祎(首都医科大学附属北京同仁医院检验科),刘治娟(西藏自治区人民医院检验科),娄加陶(上海市第一人民医院检验科),娄金丽(首都医科大学附属北京佑安医院检验科),卢志明(山东省立医院检验科),马亮(中日友好医院检验科),明亮(郑州大学第一附属医院检验科),穆红(天津市第一中心医院检验科),牛文彦(天津医科大学朱宪彝纪念医院检验科),欧启水(福建医科大学附属第一医院检验科),单保恩(河北省肿瘤医院检验科),孙成铭(烟台毓璜顶医院检验科),陶志华(浙江大学医学院附属第二医院检验科),汪俊军(解放军东部战区总医院检验科),王利新(宁夏医科大学总医院心脑血管病医院检验科),王培昌(首都医科大学宣武医院检验科),王清涛(首都医科大学附属北京朝阳医院检验科),王学锋(上海交通大学医学院附属瑞金医院检验科),王雅杰(首都医科大学附属北京地坛医院检验科),谢小兵(湖南中医药大学第一附属医院医学检验与病理中心),许斌(江苏省肿瘤医院临床检验中心),杨曦明(北京中医药大学东直门医院检验科),应斌武(四川大学华西医院检验科),张曼(北京世纪坛医院检验科),张新(新疆生产建设兵团总医院检验科),张义(山东省齐鲁医院检验科),郑磊(南方医科大学南方医院检验科),周宏伟(南方科技大学珠江医院检验科),周洲(中国医学科学院阜外医院检验科)